
A、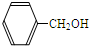 |
B、 |
C、 |
D、 |
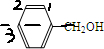 ,分子中苯环上有3种氢原子,苯环上的一溴代物有3种同分异构体,故A正确;
,分子中苯环上有3种氢原子,苯环上的一溴代物有3种同分异构体,故A正确;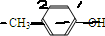 ,分子中苯环上有2种氢原子,苯环上的一溴代物有2种同分异构体,故B错误;
,分子中苯环上有2种氢原子,苯环上的一溴代物有2种同分异构体,故B错误;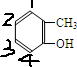 ,苯环上的一溴代物有4种同分异构体,故C错误;
,苯环上的一溴代物有4种同分异构体,故C错误; ,苯环上的一溴代物有4种同分异构体,故D错误.
,苯环上的一溴代物有4种同分异构体,故D错误.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| A、1:2 | B、1:1 |
| C、4:1 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B、若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C、达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
| D、若达到平衡时,共放出46.2kJ热量,则有l mol NH3(g)生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CaCl2溶液中通入CO2至过量 |
| B、向AlCl3溶液中滴加氢氧化钠溶液至过量 |
| C、向氢氧化铁胶体中滴加稀硫酸至过量 |
| D、向NaAlO2溶液中滴加盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:
乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
 I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com