
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )。
为阿伏加德罗常数的值。下列说法正确的是( )。
A.![]() 与
与![]() 的混合物,含离子总数为
的混合物,含离子总数为![]()
B.已知![]() 中铬元素的化合价为
中铬元素的化合价为![]() 价,则
价,则![]() 分子中存在的过氧键数目为
分子中存在的过氧键数目为![]()
C.![]() 溶液完全反应,转移电子数目一定为
溶液完全反应,转移电子数目一定为![]()
D.常温时,![]() 的盐酸中水电离的
的盐酸中水电离的![]() 数目为
数目为![]()
【答案】A
【解析】
A.Na2S和Na2O2的摩尔质量均为78g/mol,则7.8gNa2S和Na2O2的混合物的物质的量为0.1mol,1molNa2S由2molNa+和1molS2-构成,1molNa2O2由2molNa+和1mol![]() 构成,因此1molNa2S和Na2O2的混合物中含有的离子总数为0.3NA,A选项正确;
构成,因此1molNa2S和Na2O2的混合物中含有的离子总数为0.3NA,A选项正确;
B.CrO5中铬元素的化合价为+6价,根据化合物中元素的化合价代数和为0可知,CrO5中1个O显-2价,4个O显-1价,则CrO5中有2个过氧键,因此1molCrO5分子中存在的过氧键数目为2NA,B选项错误;
C.H2O2完全分解生成H2O和O2时,O元素的化合价有升高也有降低,即1molH2O2完全反应时转移的电子数为NA,C选项错误;
D.溶液体积位置,不能确定溶液中水电离出的OH-数目,D选项错误;
答案选A。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
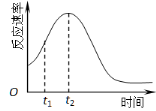 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(仅含三种短周期元素)是一种储氢材料,X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究X的组成和性质,设计并完成了如下实验。(金属互化物——全部由金属元素组成的化合物)
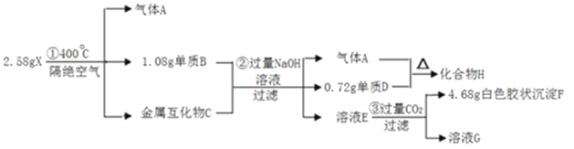
(1)写出H的电子式:________。
(2)X在400℃下分解的化学方程式:________。
(3)下列说法中正确的有:________。
A.化合物H可以与水反应生成氢气 B.单质D可以在干冰中燃烧 C.往溶液E中逐滴加入稀盐酸,将立刻产生白色沉淀 D.溶液G的成分可用于泡沫灭火器
(4)金属化合物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。![]() 、
、![]() 常用作锂离子电池的正极材料,请回答下列问题:
常用作锂离子电池的正极材料,请回答下列问题:
(1)基态锂原子的最高能级的电子云形状是________;基态磷原子有________个未成对电子;基态铁原子核外电子排布式为________。
(2)![]() 中
中![]() 的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
的配位数为4,配体中N的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)![]() 在水中易被还原成
在水中易被还原成![]() ,而在氨水中可稳定存在,其原因为________。
,而在氨水中可稳定存在,其原因为________。
(4)![]() 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
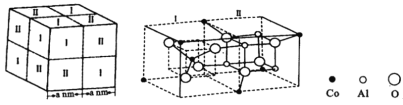
(5)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成。晶体中![]() 占据
占据![]() 形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________
形成的________(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为___________![]() (列出计算式,用
(列出计算式,用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=______,如升高温度,K值将_____(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是____________.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
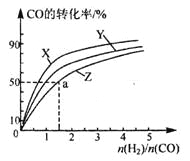
上图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是____________。由起始达到a点所需时间为5min,则H2的反应速率____________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,正极是_____极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应aA(g)+bB(g)![]() cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
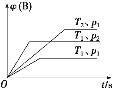
A. p1<p2,T1>T2,a+b<c,ΔH>0
B. p1<p2,T1>T2,a+b>c,ΔH>0
C. p1>p2,T1<T2,a+b<c,ΔH<0
D. p1>p2,T1<T2,a+b>c,ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com