
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 将铝片改为铝粉,做铝与氧气反应的实验 |
分析 常见增大化学反应速率的措施有:增大浓度、压强,升高温度,使用催化剂等,增大单位体积的活化分子数目或增大活化分子百分数,从而增大反应速率,注意催化剂有正负之分,负催化剂降低反应速率,以此解答该题.
解答 解:A.水没有浓度,所以Na与水反应时增大水的用量不影响反应速率,故A错误;
B.浓硫酸和Fe发生钝化现象,且不生成氢气,生成二氧化硫,故B错误;
C.在溶液中进行的反应,加压对反应速率无影响,故C错误;
D.将铝片改为铝粉,增大了反应物的接触面积,反应速率加快,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对化学反应速率影响原理是解本题关键,注意各个条件的适用范围和适用条件,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 硫元素被氧化 | B. | O2失去电子 | ||
| C. | CuS仅作还原剂 | D. | 反应中Cu元素化合价没有发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯能发生加成反应,而丙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能使酸性高锰酸钾溶液褪色,而聚乙烯不能 | |
| D. | 烃类物质都能燃烧生成二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 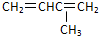 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. | CH3CH(OH)CH2CH32-羟基丁烷 | ||
| C. |  顺-2-丁烯 顺-2-丁烯 | D. | CH3CH(NH2)CH2COOH 3-氨基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com