
【题目】常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的pH与氢氧化钠溶液体积V的关系如图所示。下列说法不正确的是( )
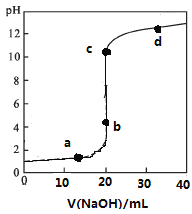
A.可选酚酞或甲基橙作指示剂
B.滴定前HR溶液中存在大量HR分子
C.V=20mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2
D.c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+)
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的描述不正确的是( )
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。
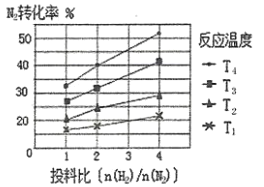
①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
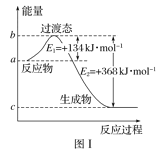
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
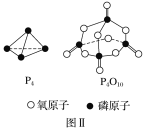
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molSO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
A.SO2和SO3共2molB.生成SO32mol
C.放出197kJ热量D.含氧原子共8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由慢到快的顺序是

A.(5)(2)(1)(3)(4) B.(5)(1)(2)(4)(3)
C.(4)(2)(1)(3)(5) D.(4)(3)(1)(2)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com