
| A. | X、Y、Z、W四种元素的简单氢化物中,Y的气态氢化物最稳定 | |
| B. | Y、Z、W四种元素的原子半径由大到小的顺序为:Y>Z>W | |
| C. | X、Z和W三种元素形成的简单离子的半径由大到小的顺序为:W>Z>X | |
| D. | Y、Z和W三种元素的最高价氧化物对应的水化物都是强酸 |
分析 X、Y、Z、W为四种短周期主族元素,原子序数依次增大;X、Z同主族,Y、Z同周期,X原子最外层电子数是核外电子层数的3倍,且X位于第二周期,则X为O元素,Z为S元素;
Y原子的最外层电子数是次外层电子数的一半,则Y为Si元素;
W的最高正价与最低负价代数和为6,W为Cl元素;
A.元素的非金属性越强,其氢化物的稳定性越强;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.硅酸是弱酸.
解答 解:X、Y、Z、W为四种短周期主族元素,原子序数依次增大;X、Z同主族,Y、Z同周期,X原子最外层电子数是核外电子层数的3倍,且X位于第二周期,则X为O元素,Z为S元素;
Y原子的最外层电子数是次外层电子数的一半,则Y为Si元素;
W的最高正价与最低负价代数和为6,W为Cl元素;
A.元素的非金属性越强,其氢化物的稳定性越强,这几种元素非金属性最强的是O元素,则氢化物最稳定的是X,故A错误;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Y、Z、W位于同一周期,且原子序数依次增大,则Y、Z、W四种元素的原子半径由大到小的顺序为:Y>Z>W,故B正确;
C.离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径Z>W>X,故C错误;
D.硅酸是弱酸,硫酸和高氯酸是强酸,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期表结构、元素周期律等知识点是解本题关键,注意离子半径比较方法,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液,点在干燥的pH试纸上,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 将Cu与浓硫酸反应剩余的液体加入到盛有蒸馏水的烧杯中,以证明反应生成了CuSO4 | |
| D. | 用乙醇、乙酸制取乙酸乙酯的过程中发现忘加碎瓷片,可立即补加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
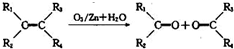 (其中R、R1、R2、R3和R4均表示烃基)
(其中R、R1、R2、R3和R4均表示烃基)
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属两原子间不可能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物 | |
| C. | 含有非极性键的分子,不一定是共价化合物 | |
| D. | 离子化合物中一定不含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 离子的氧化性:X+<W3+ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛分子中的所有原子都在同一平面上 | |
| B. | 凡是能发生银镜反应的有机物都是醛 | |
| C. | 完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等 | |
| D. | 醛类既能被氧化为羧酸,又能被还原为醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
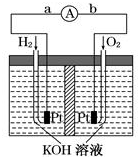 氢氧燃料电池是符合绿色化学理念的新型发电装置,图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置,图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 醋酸的电离平衡常数Ka=c(CH3COO-)•c(H+) | |
| C. | 若将溶液的温度升高到100℃,c(OH-)减小 | |
| D. | 加水稀释后H+的物质的量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com