
| A、增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大 |
| B、粗铜精炼时,电解质液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的是电化学腐蚀 |
| D、阴极电保护法是将被保护的金属与外加电源的负极相连 |


科目:高中化学 来源: 题型:
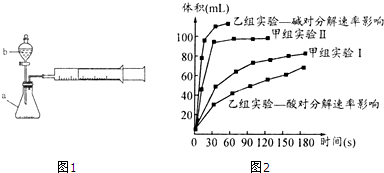
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2% H2O2 |
| 甲组实验Ⅱ | 25 | 10ml 5% H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、Na2CO3 |
| D、干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、①③⑤ |
| C、③④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、950 mL 111.2 g |
| B、500 mL 117.0g |
| C、1000 mL 117.0 g |
| D、1000 mL 114.7 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com