
【题目】(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
实验 | 消耗0.1000molL﹣1的 | 待测氢氧化钠 |
1 | 29.02 | 25.00 |
2 | 28.01 | 25.00 |
3 | 27.99 | 25.00 |
(1)如图所示A的pH范围使用的指示剂是;
(2)用0.1000molL﹣1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是molL﹣1 . 在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
【答案】
(1)酚酞
(2)0.1120;偏高
(3)AC
【解析】解:(1)甲基橙、酚酞的变色范围分别是pH在3.1﹣4.4,8.2﹣10之间,A区pH范围使用的指示剂是酚酞; 所以答案是:酚酞;(2)据表分析,实验1的数据与实验2实验3差别太大,可忽略,实验2和实验3的盐酸溶液的体积平均值V(HCl)= ![]() =28.00mL,则c(NaOH)=
=28.00mL,则c(NaOH)= ![]() =
= ![]() =0.1120mol/L;
=0.1120mol/L;
在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大;
分析,可知c(待测)偏大;
所以答案是:0.1120;偏高;(3)A、待测的烧碱溶液必须用碱式滴定管量取,故A正确;
B、盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大,故B错误;
C、滴定过程中两眼应注视锥形瓶中溶液颜色的变化,故C正确;
D、量取待测液需精确到0.01mL,必须用滴定管量取,故D错误;
所以答案是:AC.
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.


科目:高中化学 来源: 题型:
【题目】某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). 
(1)该物质的结构简式为
(2)该物质中所含官能团的名称为 .
(3)下列物质中,与该产品互为同系物的是(填序号) , 互为同分异构体的是 . ①CH3CH═CHCOOH ②CH2═CHCOOCH3
③CH3CH2CH═CHCOOH ④CH3CH(CH3)COOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( ) 
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O
D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数,据报道,科学家已成功合成了少量N4 , 有关N4的说法正确的是( )
A.N4和N2是互为同位素
B.1molN4分子含有28NA个电子
C.相同质量的N4和N2所含原子个数比为2:1
D.N4的摩尔质量是56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,用以分离 KCl和BaCl2两种混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
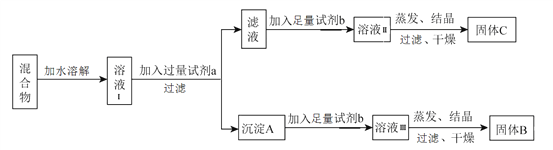
下列说法中,正确的是
A. 试剂 a是K2SO4 溶液
B. 试剂 b是盐酸
C. 固体 C是BaCl2
D. 不加试剂 b,将滤液直接蒸发、结晶,过滤后干燥也能得到纯净的固体C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含浓度均为0.1mol/L的硫酸、硫酸铜的混合溶液200mL,加入一定质量的锌片,生成气体224mL(标准状况下), 则加入锌片的质量为
A. 0.65g B. 1.3g C. 1.95g D. 2.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素M、N、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系。甲、丁为二元化合物(两种元素形成的化合物),乙、戊为单质,丙、己为三元化合物。已知25℃时,0.1mol/L的甲、丙两溶液的pH分别为l、13 ,丁、己两溶液混合时产生白色沉淀。下列推断正确的是( )
A.M分别与N、X、Z形成的简单化合物中,M与N形成的化合物熔点最高
B.原子半径:Z>Y>X>M>N
C.X、Y、Z的最高价氧化物对应的水化物能相互反应
D.Z的阴离子结合质子的能力比N的阴离子强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na2O2与CO2反应:_______________
(2)加热使NaHCO3分解:____________
(3)Al与NaOH溶液反应:______________
(4)Fe(OH)2长时间露置于空气中:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
A. +2 价 B. +3 价 C. +4价 D. +5价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com