
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、②③④⑤ |
| C、①②④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
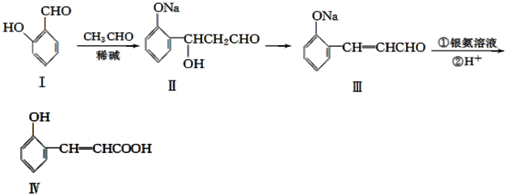
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | M | R |
| A、Z的氧化物可以做光导纤维 |
| B、气态氢化物稳定性:M>R |
| C、最高价氧化物对应水化物的酸性:Y>X |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ?mol-1 I2=1817KJ?mol-1 I3=2745KJ?mol-1I4=11575KJ?mol-1 I5=14830KJ?mol-1 I6=18376KJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 | ||
| A | 取待检液,滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 含有SO42- | ||
| B | 取待检液,滴加氯水后再加几滴KSCN溶液 | 溶液呈红色 | 含有Fe2+ | ||
| C | 用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉 | 仍然有固体存在 | 反应后溶液中一定有Fe2+ | ||
| D | 取待检液,加入盐酸将产生的气体通入澄清石灰水 | 石灰水变浑浊 | 含有CO32-或SO
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com