
【题目】氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200℃.导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.制取原理为:Al2O3 + 3C + N2![]() 2AlN + 3CO
2AlN + 3CO
(1)氮化铝的晶体类型为___________。
(2)制取氮化铝要用较为纯净的N2,N2的电子式为____________。实验室中制备少量氮气
的基本原理是:NH4Cl + NaNO2 =NaCl + 2H2O + N2↑。为了得到较纯净的N2,最好的收集方法是____________。
(3)氮化铝抗酸能力极强,但抗碱蚀能力差,它能与氢氧化钠溶液反应生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,其化学反应方程式为:___________________
(4)工业上制得的AlN中含有Al2O3 、C杂质,取含杂质的粗氮化铝10.00g于某容器,加入足量浓硫酸,加热,收集到672mL气体(已折算成标准状况)。则该粗氮化铝中碳的质量分数为___________
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】COS 、H2S是许多煤化工产品的原料气。已知
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=X kJ·mol-1;
H2S(g)+CO(g) △H=X kJ·mol-1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1;
(1)断裂1 mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1319 | 442 | 1076 | 678 | 930 | 1606 |
X=___________。
(2)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应,在T10C时达到平衡,体系内CO的体积分数为5%(如下图M点)。

请回答下列问题:
①请在图中画出以M为起点,从T1℃开始升温过程中CO的平衡体积分数随温度变化的曲线。_____
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol,则平衡时H2O的转化率为_________。
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M中充入1 mol CO和1 mol H2O,在N中充入1 mol CO2和1 mol H2,均在700 ℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_______。
A.容器M、N中正反应速率相同
B.容器M中CO的物质的量比容器N中的多
C.容器M、N中反应的平衡常数相同
D.容器M中CO的转化率与容器N中CO2的转化率之和小于1
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
______________________________________;常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL(标况)H2S气体,反应后离子浓度从大到小顺序为_____________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示:

①25℃时Ksp(CuS)=__________________。
②25℃时向50.0mL Sn2+、Cu2+浓度均为0.01mol·L-1的混合溶液中逐滴加入Na2S溶液到50.0mL时开始生成SnS沉淀,此时溶液中Cu2+浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_____________。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_______(填化学式),呈现如此递变规律的原因是_______________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________,另一种的晶胞如图二所示,该晶胞的空间利用率为__________,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________ ![]() (保留两位有效数字)。(
(保留两位有效数字)。(![]() )。
)。
(4)D元素形成的单质,其晶体内含有的微粒间作用力是_________,D的醋酸盐晶体局部结构如图三,请用箭头标出图中的配位键。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。完成下列填空:

(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有___________
(2)上述装置中,A是___________溶液,其作用是___________ 。
(3)上述装置中,B物质是___________。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的____________类,为了将石蜡从饭盒中溶出,应选用下列试剂中的__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:
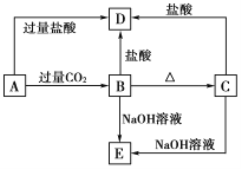
(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石油和煤的叙述中,不正确的是
A. 煤的干馏属于化学变化
B. 石油分馏得到的汽油是混合物
C. 煤的气化和液化是物理变化
D. 石油裂化和裂解可以得到乙烯、丙烯等重要基本化工原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com