
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:
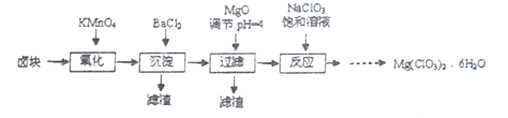
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
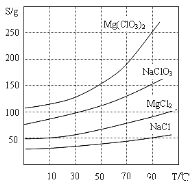
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有_________。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________;______;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______。(保留到小数点后一位)
【答案】 烧杯、漏斗、玻璃棒 Fe(OH)3 MgCl2+2NaC1O3=Mg(C1O3)2+2NaCl↓ 蒸发浓缩或蒸发结晶 趁热过滤 ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O 78.3%
【解析】本题是一道无机物质制取的工艺流程题,解答此类题目必须弄懂每一步流程中发生的反应和物质的转化关系。
(1)过滤所需要的主要玻璃仪器有:烧杯、漏斗、玻璃棒。
(2)加KMnO4的目的是氧化Fe2+使其转化为Fe3+,再加入BaCl2除去SO42-, 此时溶液中的溶质主要为MgCl2、FeCl3, Fe3+发生水解:Fe3++3H2O![]() Fe(OH)3+3HCl,加入的MgO与水解得到的H+反应,促使上述平衡正向移动从而使Fe3+转化为Fe(OH)3沉淀而与MgCl2分离,故加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3。
Fe(OH)3+3HCl,加入的MgO与水解得到的H+反应,促使上述平衡正向移动从而使Fe3+转化为Fe(OH)3沉淀而与MgCl2分离,故加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3。
(3)过滤后的溶液中的溶质为MgCl2,加入NaClO3后生成的NaCl的溶解度小,在饱和溶液中以沉淀的形式析出,故反应可以发生,化学方程式为:MgCl2+2NaC1O3=Mg(C1O3)2+2NaCl↓;
加入NaClO3后生成Mg(C1O3)2溶液和NaCl沉淀,可以先将混合物蒸发浓缩,使更多的NaCl沉淀析出,由于Mg(C1O3)2的溶解度随温度的降低而降低,同时为了减少Mg(C1O3)2的析出,必须在较高温度下过滤,得到Mg(C1O3)2滤液,洗涤沉淀得到NaCl产品。最后对滤液进行冷却结晶,得到Mg(ClO3)2·6H2O晶体。故答案为:蒸发浓缩或蒸发结晶、趁热过滤。
(4)①ClO3-具有氧化性,Fe2+具有还原性,两者在酸性条件中反应,离子方程式为: ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O ;②根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,K2Cr2O7溶液滴定的Fe2+的物质的量为6×0.100×15.00×10-3mol=9×10-3mol,所以ClO3-消耗的Fe2+的物质的量为20×10-3mol-9×10-3mol=0.011mol,根据ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O可得ClO3-的物质的量为0.011/6mol,所以原100ml样品溶液中ClO3-的物质的量为0.011/6mol×10=0.11/6mol,Mg(ClO3)2·6H2O的物质的量为0.11/12mol,质量为(0.11/12)×299g,故Mg(ClO3)2·6H2O的质量分数为(0.11/12)×299g÷3.5×100%=78.3%。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的Cl会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
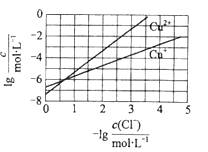
A. Ksp(CuCl)的数量级为![]()
B. 除Cl反应为Cu+Cu2++2Cl![]() 2CuCl
2CuCl
C. 加入Cu越多,Cu+浓度越高,除Cl效果越好
D. 2Cu+![]() Cu2++Cu平衡常数很大,反应趋于完全
Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
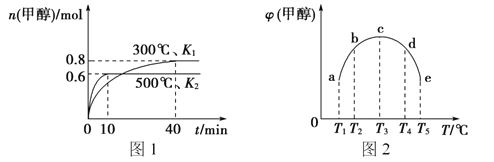
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5 kJ/mol
②2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol
③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7 kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:__________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
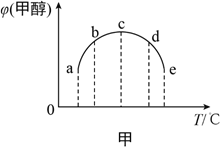
①温度升高甲醇的体积分数增大的原因是__________.
②根据图像判断ΔH__________(填“>”、“<”或“=”)0。
(3)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | A | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=__________;反应温度T1__________T2(填“大于”或“小于”。)
②容器Ⅱ中a=__________。
③下列说法能说明反应达到平衡状态的是__________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.混合气体中c(CH3OCH3)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为石油裂解的主要产物,相对分子质量为28。B为气体,在标准状况下的密度为1.965g·L-1。D与F互为同分异构体,F是环状化合物。G的结构简式为:![]() 。在一定条件下,它们有如图所示的转化关系。
。在一定条件下,它们有如图所示的转化关系。
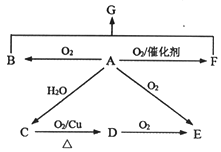
请回答:
(1)E中所含官能团名称________。
(2)B与F反应生成G的反应类型________。
(3)C→D的化学方程式________。
(4)下列说法正确的是________。(填编号)
A.A与O2在催化剂作用下反应也可以生成D B.不可以用金属钠检验C中是否含有少量水
C.可以用NaHCO3溶液鉴别C、D、E的水溶液 D.G可以在NaOH溶液或稀硫酸中发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)B是____________,W是__________。(填化学式)
(2)用单线桥法标出反应①电子转移的方向和数目:_________________。
(3)写出G与Cu在加热条件下能反应生成E和F的物质的量之比为1∶1的化学方程式:________________________________________________________________________。
(4)若W是酸式盐,_________g W加热分解的产物通过足量的Na2O2,固体Na2O2增重3g,则转移的电子总数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
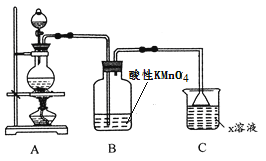
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为____________。C装置的作用_____________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
验证该气体的实验方案如下:
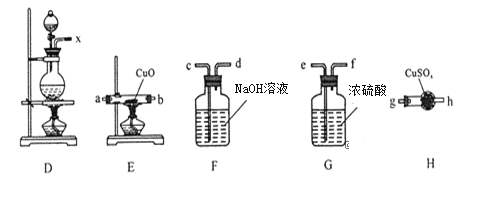
①装置连接顺序:X→ ___→___→___→___→a→b→_____;
②能证明上述假设成立的实验现象是_____________。
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处__________________________。
④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的某离子,可供选用的试剂: a、Cl2;b、Br2;c、稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填字母),反应的离子反应方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温条件下一定能进行
C.NaOH固体溶于水是放热反应
D.A+B=C+D是放热反应,说明A和B物质的总能量高于C和D的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com