
| A. | 酸性氧化物 | B. | 电解质 | C. | 离子化合物 | D. | 有机物 |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:解答题
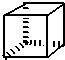 “立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示:
“立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示: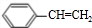 ;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有
;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有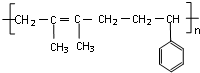
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
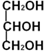 )与足量丙酸(CH3CH2COOH)发生酯化的反应方程式:
)与足量丙酸(CH3CH2COOH)发生酯化的反应方程式: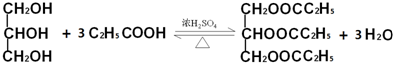
 若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.
若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
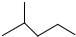 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.| 实验步骤 | 解释或实验结论 |
| (1)称取A物质 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: ?A的相对分子质量为:90 |
(2)A的核磁共振氢谱如图: | ?A中含有4种氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
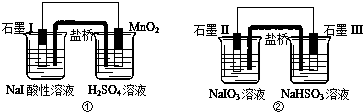
| A. | 两个装置中石墨I和石墨II作负极 | |
| B. | 碘元素在装置①中被氧化,在装置②中被还原 | |
| C. | ①中MnO2的电极反应式为:MnO2+2H2O+2e-═Mn2++4OH? | |
| D. | 反应①、②中生成等量的I2时导线上通过的电子数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com