
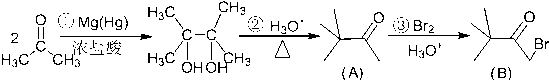
 .
.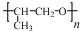 ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: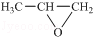 .
.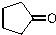 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: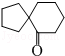 .
. 分析 (1)反应①为加成反应,③为取代反应,同时还生成HBr;
(2)B中官能团为羰基、溴原子;
(3)得到的烃中含有6个碳原子、14个H原子,2号C上含有2个甲基,主链上含有4个C原子;
(4)B中溴原子能和NaOH的水溶液发生取代反应;
(5)该高分子化合物中的两个半键相连即得其单体;
(6)根据图中断键和成键方式判断该产物结构简式.
解答 解:(1)对比(A)与(B)的结构可知,(A)中连接羰基的甲基上H原子被Br取代生成(B),是取代反应,同时生成HBr,
故答案为:取代反应;HBr;
(2)根据(B)的结构简式可知所含官能团的名称为羰基、溴原子,
故答案为:羰基、溴原子;
(3)中间产物(A)可经过著名的黄鸣龙还原法,直接得到对应相同碳骨架的烷烃,则该烷烃为(CH3)3CCH2CH3,分子式为C6H14,名称为2,2-二甲基丁烷,
故答案为:C6H14;2,2-二甲基丁烷;
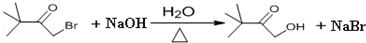
(4)(B)与氢氧化钠的水溶液共热发生水解反应得到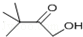 与HBr,HBr又与氢氧化钠发生中和反应,反应方程式为:
与HBr,HBr又与氢氧化钠发生中和反应,反应方程式为: ,
,
故答案为: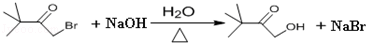 ;
;
(5)发生加聚反应得到高聚物,将高聚物链节中半键连接可得高聚物单体为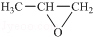 ,
,
故答案为: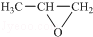 ;
;
(6)反应①中C=O双键中其中一个碳氧单键断裂,氧原子结合H原子形成羟基,而C原子相互连接,反应②中羟基与甲基交换,发生重排,同时2羟基脱去(1分)子水生成羰基,戊酮(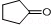 )发生上述路线中反应①得到
)发生上述路线中反应①得到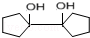 ,再经过反应②之后,得到的有机产物的结构简式为
,再经过反应②之后,得到的有机产物的结构简式为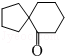 ,
,
故答案为: .
.
点评 本题考查有机合成,为高频考点,侧重考查学生分析判断能力,明确常见反应类型、有机物官能团及其性质关系、断键和成键方式是解本题关键,注意(6)题采用知识迁移方法分析解答,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 反应KIO3+6HI═KI+3H2O+3I2中,生成3molI2转移电子的总数为5NA | |
| D. | 12g石墨和C60的混合物中质子总数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
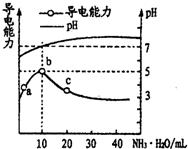
| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 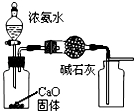 制取并收集干燥纯净的NH3 | |
| B. | 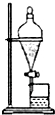 用该装置分离乙酸乙酯和饱和碳酸钠溶液 | |
| C. | 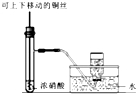 用于制备并收集少量NO2 | |
| D. | 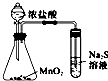 比较MnO2、Cl2、S的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
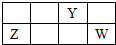 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
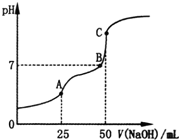
| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com