
| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
分析 A.pH=0的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子和溴离子;
B.由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液为酸性或碱性溶液,偏铝酸根离子与酸性溶液中的氢离子反应;
C.铁离子、铝离子只能存在于中性溶液中;
D.四种离子之间不反应,都不与碳酸钠反应.
解答 解:A.pH=0的溶液为酸性溶液,NO3-在酸性条件下能够氧化Fe2+、Br-,在溶液中不能大量共存,故A错误;
B.由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中存在电离氢离子或氢氧根离子,AlO2-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.Fe3+、Al3+只能存在于酸性溶液,在中性溶液中不能大量共存,故C错误;
D.A1O2-、Na+、NO3-、C1-之间不发生反应,都不与Na2CO3反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的两物质分别与足量盐酸充分反应时,NaHCO3产生CO2气体多 | |
| B. | 可以用澄清石灰水或者氢氧化钠溶液区别 | |
| C. | 等质量的两物质分别与足量的等浓度盐酸反应时,一般是Na2CO3产生CO2气体快 | |
| D. | NaHCO3中Na2CO3混有杂质可以用加热方法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )
能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
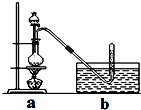
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
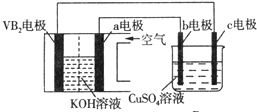
| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
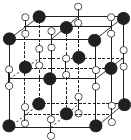 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.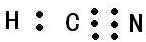 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com