
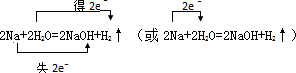 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移. 分析 (1)含元素化合价变化的反应为氧化还原反应,水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原;
(2)只有HCl为强电解质,完全电离,其它物质均需保留化学式;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,以此来解答.
解答 解:(1)只有①⑤反应中没有元素的化合价变化,不属于氧化还原反应;只有③水中O元素的化合价升高,水被还原;只有④水中H元素的化合价降低,水被氧化;只有②中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,
故答案为:①⑤;④;③;
(2)Cl2+H2O=HCl+HClO的离子反应为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Na元素的化合价由0升高为+1价,H元素的化合价由+1价降低为0,电子转移的方向和数目为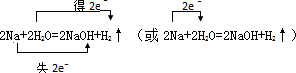 ,
,
生成1molH2,转移2mol电子,所以产生0.2mol的气体,转移电子的物质的量为0.4mol,故答案为: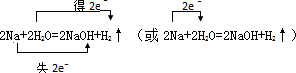 ;0.4.
;0.4.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
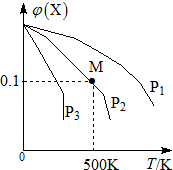 某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )
某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )| A. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ | |
| B. | 压强大小有P3>P2>P1 | |
| C. | 平衡后加入高效催化剂使气体相对分子质量增大 | |
| D. | 升高温度,该反应平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质 | |
| C. | NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验 | |
| D. | 打磨磁石制指南针不涉及化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
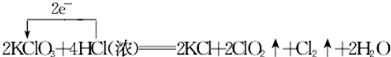 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
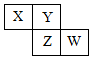 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 化学变化 | 物理变化 |
| B | 氧化还原反应 | 分解反应 |
| C | 氧化还原反应 | 化合反应 |
| D | 中和反应 | 复分解反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com