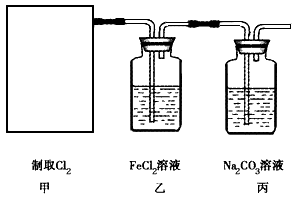
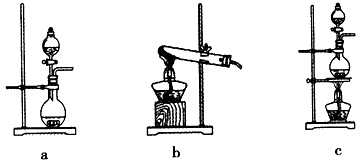
(2011?浙江)食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:IO
3->Fe
3+>I
2;还原性:S
2O
32->I
-3I
2+6OH
-═IO
3-+5I
-+3H
2O;
KI+I
2
KI
3(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO
3、KI、Mg
2+、Fe
3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl
4萃取,下层溶液显紫红色;第三份试液中加入适量KIO
3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是
Fe(SCN)3
Fe(SCN)3
(用化学式表示);CCl
4中显紫红色的物质是
(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为
IO3-+5I-+6H+═3I2+3H2O
IO3-+5I-+6H+═3I2+3H2O
、
2Fe3++2I-═2Fe2++I2
2Fe3++2I-═2Fe2++I2
.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式:
4KI+O2+2H2O═2I2+4KOH
4KI+O2+2H2O═2I2+4KOH
.将I
2溶于KI溶液,在低温条件下,可制得KI
3?H
2O.该物质作为食盐加碘剂是否合适?
否
否
(填“是”或“否”),并说明理由
KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华
KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华
.
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是
AC
AC
.
A.Na
2S
2O
3 B.AlCl
3 C.Na
2CO
3 D.NaNO
2(4)对含Fe
2+较多的食盐(假设不含Fe
3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe
2+.
取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
.



 KI3
KI3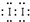
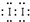

 室温下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和(假设Cl2在水中只发生如下反应:Cl2+H2O=HCl+HClO,溶液中c(H+)变化入下图中的曲线a.已知Cl2的溶解度随温度的升高而迅速降低,下列叙述中正确的( )
室温下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和(假设Cl2在水中只发生如下反应:Cl2+H2O=HCl+HClO,溶液中c(H+)变化入下图中的曲线a.已知Cl2的溶解度随温度的升高而迅速降低,下列叙述中正确的( ) 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。