
化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 mol•L-1,此时溶液中的c(H+)<_________mol•L-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+  Cr2O72-
Cr2O72-  I2
I2 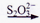 S4O62-
S4O62-
① 上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 mol•L-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
已知反应Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是(_____)
A.电极X是正极,其电极反应为Cu-2e-=Cu2+
B.银电极质量逐渐减小,Y溶液中c(Ag+)增大
C.实验过程中取出盐桥,原电池仍继续工作
D.当X电极质量减少0.64g时,外电路中有0.02mol电子转移
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高二(平行班)3月月考化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和. 下列说法正确的是( )
A. 原子半径C>D>E,三者形成的简单离子中D离子的半径最小
B. 元素A所形成的氢化物常温下一定为气态
C. 元素C、D、E在自然界中均不能以游离态存在
D. 元素B的氧化物对应的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三第四次月考化学试卷(解析版) 题型:实验题
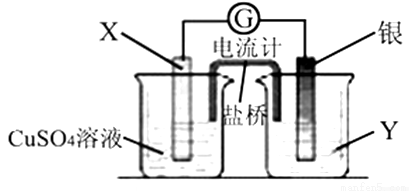
(17分)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三第四次月考化学试卷(解析版) 题型:选择题
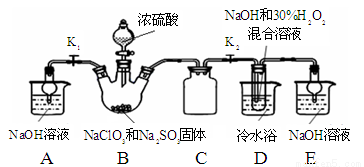
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4溶液 | 溶液紫色褪去 | 制得的气体为乙烯 |
B | 测定等浓度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C | 向2.0ml浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡 | 沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中先滴加Ba(NO3)2溶液, 再滴加稀盐酸 | 出现白色沉淀 | 原待测液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二下学期学业水平测试(二)化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温常压下,80 g SO3含有的原子数目为NA
B. 常温常压下,22.4 L甲醛(HCHO)含有的原子数目为4NA
C. 铝热反应中,每1 molAl参加反应,失去的电子数目为3NA
D. 1.0L 0.5mol/LKClO3溶液中含有的氯离子数目为0.5 NA
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月高考模拟化学试卷(解析版) 题型:选择题
在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
A. CO2 B. PCl3 C. CCl4 D. H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com