
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1mol H2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式________ 。
(2)已知:乙苯催化脱氢制苯乙烯反应:苯在计算键能时,此处可看作为![]() ,
, ![]()
![]()
![]() +H2(g)
+H2(g)
化学键 | C—H | C—C | C=C | H—H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=________ kJ·mol-1。
Ⅱ.25 ℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:________。
【答案】NaOH(aq)+ ![]() H2SO4(aq)═
H2SO4(aq)═![]() Na2SO4(aq)+ H2O(l)△H=-57.3 kJ·mol-1 +124 CH3COOH >H2CO3>HClO CO2+H2O+ClO-=HClO+HCO3-
Na2SO4(aq)+ H2O(l)△H=-57.3 kJ·mol-1 +124 CH3COOH >H2CO3>HClO CO2+H2O+ClO-=HClO+HCO3-
【解析】
Ⅰ.(1)中和热为稀的酸和碱发生反应后生成1mol水时放出的热量,因此稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)═
H2SO4(aq)═![]() Na2SO4(aq)+ H2O(l)△H=-57.3 kJ·mol-1;
Na2SO4(aq)+ H2O(l)△H=-57.3 kJ·mol-1;
(2)△H=E反应物总键能-E生成物总键能,△H=[5 (C—H)+(C—C)]-[3 (C—H)+(C=C)+(H—H)]=5×412+348-3×412-612-436=+124 kJ·mol-1;
Ⅱ. (1)电离平衡常数越大,溶液中的氢离子越多,酸性越强,故CH3COOH >H2CO3>HClO;
(2)碳酸的第一电离常数大于次氯酸的电离常数,但碳酸的第二电离常数小于次氯酸的电离常数,根据强酸制弱酸,少量CO2气体通入NaClO溶液中,其化学反应方程式为:CO2+H2O+NaClO=HClO+NaHCO3,其离子反应方程式为:CO2+H2O+ClO-=HClO+HCO3-。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上常用电解对含氮生活污水进行处理。若污水中含有Cl-,主要靠有效氯(HC1O、ClO-)将NH4+氧化为N2。其工作原理如图所示,下列分析正确的是
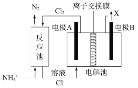
A.电极A为阴极
B.电极B上发生电极反应:2H++2e-=H2↑
C.电解池中离子交换膜为阴离子交换膜
D.处理含l mol NH4+的废水,反应池中共转移电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,不正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) H=-57.4kJmol-1
B.根据C(石量,s)=C(金刚石,s) H>0 可知石墨比金刚石稳定
C.根据2H2(g)+O2(g)=2H2O(l) H=-483.6 kJmol-l可知H2的燃烧热为241.8kJmol-1
D.由C(s)+O2(g)=CO2(g) H1,C(s)+![]() O2(g)=CO(g) H2 可知 H1>H2
O2(g)=CO(g) H2 可知 H1>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在绝热恒容密闭容器一定条件下使反应2A(g)+B(s)![]() 3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
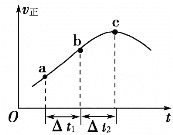
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应ΔH>0
D.Δt1=Δt2时,a~b段消耗A的量小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__________;第一电离能I1(Si) ____ I1(Ge)(填“>”或“<”)。
(2)基态Ge原子核外电子排布式为_____________;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是________,原因是______。
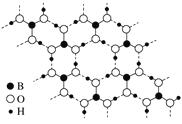
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为________;硼酸在热水中比在冷水中溶解度显著增大的主要原因是_____________。
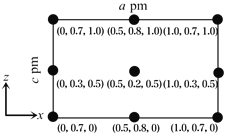
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a pm,b pm和c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_______;CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____________g·cm-1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是![]()
A.HF是卤族元素的氢化物中沸点最高的,因为HF分子间存在氢键,所以![]() 也是同族元素氢化物中沸点最高的
也是同族元素氢化物中沸点最高的
B.NaCl与浓硫酸加热可制得HCl,推测NaI与浓硫酸加热可制得HI
C.因为AgCl、AgBr、AgI均难溶,推测AgF也难溶于水
D.由于还原性![]() ,推测还原性
,推测还原性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素或者化合物性质的比较中,正确的是![]()
![]()
A. 结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以![]()
B. Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C. 在分子中,两个原子间的键长越长,键能越大
D. 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com