
c(HC
| ||
c(C
|
| n(HCO3-) |
| n(CO32-) |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:黑龙江省鹤岗一中2010-2011学年高一下学期期末考试化学试题 题型:013
|
一定温度下,可逆反应A2(s)+3B2(g) | |
| [ ] | |
A. |
容器内每减少1 mol A2,同时消耗2 mol AB3 |
B. |
容器内nA2∶nB2∶nAB3=1∶3∶2 |
C. |
混合气体总的物质的量 |
D. |
容器内的气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省高一下学期期末考试化学试卷 题型:选择题
一定温度下,可逆反应A2(s)+3B2(g)
 2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是
A.容器内每减少1mol A2,同时消耗2mol AB3
B.容器内nA2:nB2:nAB3=1:3:2
C.混合气体总的物质的量
D.容器内的气体密度不再改变
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
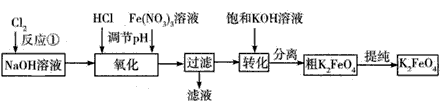
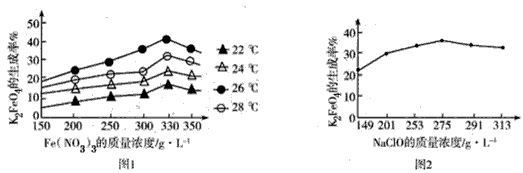
 4Fe(OH)3+8OH-+3O2↑。在“提纯”K2FeO4的过程中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__(填序号)。
4Fe(OH)3+8OH-+3O2↑。在“提纯”K2FeO4的过程中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__(填序号)。 查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,可逆反应A2(s)+3B2(g) 2AB3(g)在可变容器中不能作为达到平衡的标志是
A.容器内每减少1mol A2,同时消耗2mol AB3
B.容器内nA2:nB2:nAB3=1:3:2
C.混合气体总的物质的量
D.容器内的气体密度不再改变
查看答案和解析>>
科目:高中化学 来源:2010—2011学年黑龙江省鹤岗一中高一下学期期末考试化学试卷 题型:单选题
一定温度下,可逆反应A2(s)+3B2(g) 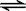 2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是
| A.容器内每减少1mol A2,同时消耗2mol AB3 |
| B.容器内nA2:nB2:nAB3=1:3:2 |
| C.混合气体总的物质的量 |
| D.容器内的气体密度不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com