

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
分析 (1)依据化学方程式和平衡常数概念书写,平衡常数等生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应是放热反应,随温度升高,平衡逆向进行;平衡常数是衡量反应进行程度的物理量,平衡常数K值越大,说明正向进行程度越大;
(2)减少生成物的浓度,化学平衡向着正向移动,氨气易液化;
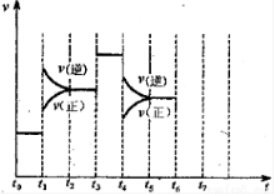
(3)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3正逆反应速率同等程度的增大;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(4))由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析.
解答 解:①,工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g),△H=-92.44kJ/mol,平衡常数为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,反应是放热反应,随着温度的升高平衡逆向进行,平衡常数减小;平衡常数K值越大反应这些进行的程度越大,
A.正向进行越大,N2的转化率越高,故A正确;
B.反应正向进行,生成的氨气越多,NH3的产率越大,故B正确;
C.反应正向进行,原料中N2的含量减少,故C错误;
D.平衡常数越大,说明正向进行程度越大,但化学反应速率不一定越快,故D错误;
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;减小;A B;
(2)根据题意可知氨气的沸点是-33.42,可以将温度降低到-33.42,让氨气分离出来,氢气和氮气可以再循环利用,故答案为:-33.42;NH3;N2、H2;
(3)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:C;E;B;
(4)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,故答案为:A.
点评 本题是一道关于化学平衡的题目,可以根据所学知识进行回答,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )| A. | c2=2c1 | B. | c2>2c1 | C. | c2<2c1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0.8 g•cm-3 | B. | 大于1.0 g•cm-3 | ||
| C. | 介于0.8~1.0 g•cm-3 | D. | 无法推测 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com