
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01mol/L时,氢氧化钾溶液的pH比氢氧化钡的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
科目:高中化学 来源: 题型:阅读理解
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.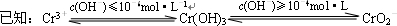 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、周期表中的族分为:主族、副族、第 VIII族和零族 | B、周期表中的周期分为:短周期、长周期和不完全周期 | C、57-71号元素放在同一位置,称为镧系元素,所以它们全部互为同位素 | D、由长、短周期元素共同组成的元素族称为主族(除零族外) |
查看答案和解析>>
科目:高中化学 来源:湖南省长郡中学2012届高三第五次月考化学试题 题型:043
| |||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
A和浓硫酸共热有两种主要产物C、D生成,如下图所示:

请回答下列问题:
(1)水杨酸的结构简式为____________;它的符合下列条件的同分异构体有____________种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③苯环上的一溴代物只有两种
(2)关于水杨酸性质的下列说法中不正确的是____________。
A.具有酸性 B.能使溴水褪色
C.该分子所有原子不可能共面 D.能发生酯化反应
(3)D的结构简式为____________,②的反应类型为____________。
(4)反应①的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com