
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.升高温度 B.加入一种反应物
C.对平衡体系增加压强 D.使用催化剂
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
区别溶液和胶体最简单的方法是
A、丁达尔现象 B、闻气味
C、过滤 D、根据分散质微粒直径
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g) + O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
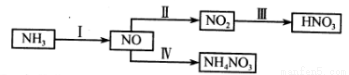
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。

①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
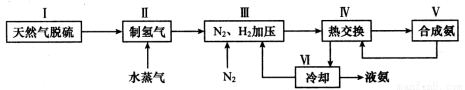
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol
CO(g)+3H2(g) △H = +206.4 kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2 kJ/mol
CO2(g)+H2(g) △H = —41.2 kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
反应A(g)+2B(g)===C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
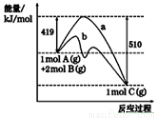
A.正反应活化能大于逆反应活化能
B.曲线b表示使用催化剂后的能量变化
C.由图可知该反应的焓变ΔH=+ 91 kJ·mol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,是为了加快化学反应速率的是

查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(16分)粗食盐中除含有泥沙等不溶性杂质外,还含有钙离子、镁离子、硫酸根离子等可溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④过滤;⑤滴入稀盐酸至无气泡产生;⑥蒸发结晶。
回答下列问题。
(1)步骤①中的BaCl2 溶液还可以换成__________(填字母)。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以
(2)步骤③中所发生反应的离子方程式为__________________________、________________________。
(3)步骤⑥需使用玻璃棒,其目的是________________________________________________________。
(4)步骤①、步骤②、步骤③的顺序还可以是______________________或________________________。
(5)用上述过程中获得的精盐配制240mL 0.8mol·L-1 NaCl溶液,步骤如下:计算→称量→溶解→转移→洗涤→定容→摇匀。
a.需要的NaCl固体质量为_________g;
b.定容时,当液面离刻度线1~2cm时应改用_________(填仪器名称)加水。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:实验题
(15分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
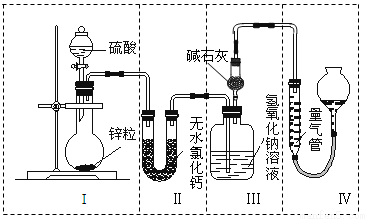
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为 ;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是 ;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)= ;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mloI·L-1H2SO4溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、HCO3-
C.0.l mol·L-lNaClO溶液:Fe2+、K+、I一、Cl-
D.c(OH-)/c(H+)=lxl014的溶液:Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com