
| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
分析 (1)分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,结合温度变化分析判断反应焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;依据某时刻浓度商计算和平衡常数比较判断反应进行的方向;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:(1)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,在500℃、2L的密闭容器中,进行反应③,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q=$\frac{0.15×0.3}{0.{8}^{3}×0.1}$=0.87<K=2.5,反应正向进行,V正>V逆,
故答案为:K1•K2;>;
(2)A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1,不能判断正逆反应速率是否相等,无法判断是否达到平衡状态,故A错误;
B.该反应是体积减小的反应,容器内压强保持不变,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C.H2的消耗速率与CH3OH的消耗速率之比为3:1,表示的是正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C正确;
D.容器内的密度保持不变,反应方程式两边都是气体,气体的总质量不变,容器的容积固定,所以反应过程中气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选BC.
点评 本题考查了化学平衡状态的判断、本题考查了化学平衡影响因素分析判断、平衡移动的方向的判断等,题目综合性强,涉及的知识点较多,充分考查了学生对书写知识的掌握与理解,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
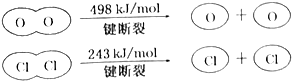
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全错 | B. | 只有④正确 | C. | ①③④正确 | D. | ①②③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com