
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 
| A.①④ | B.③④ |
| C.①②③ | D.②③ |
C
解析试题分析:图中生成氢气的反应速率先增大后减小,发生的反应为Mg+2H+═Mg2++H2↑。开始反应时浓度最大,随着反应的进行,浓度逐渐减小,如果不考虑气其它因素,反应速率应逐渐减小,但开始阶段反应速率逐渐增大,说明温度对反应速率有影响,因该反应为放热反应,放热使温度升高,则反应速率加快,故③正确;但1随着反应的进行,反应速率开始降低,这是由于反应后期溶液中氢离子的浓度降低,从而导致反应速率降低,即氢离子的浓度对反应速率有影响,即①正确;由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②正确;因Cl-不参加反应,Cl-的浓度增大或减小都不影响化学反应速率,且该反应中Cl-的浓度不变,故④错误,即影响反应速率的因素为①②③,答案选C。
考点:考查影响化学反应速率的因素
点评:该题是高考中的常见考点,属于中等难度的试题,侧重对学生分析、归纳和总结问题的能力的培养。明确反应原理和图象中的反应速率变化及影响反应速率的常见因素是解答本题的关键。


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下,中和pH与体积均相同的盐酸和醋酸消耗NaOH的物质的量相同 |
| B.纯铁和生铁在酸雨中均发生电化学腐蚀 |
| C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D.食品工业用NaHCO3作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将4 mol A气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是:①用物质A表示的反应的平均速率为0.3 mol/(L·s);②用物质B表示的反应的平均速率为0.6 mol/(L·s);③反应达到平衡时,A、B、C的反应速率一定相等;④反应达到平衡时,A、B、C的物质的量均不再变化
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是:①用物质A表示的反应的平均速率为0.3 mol/(L·s);②用物质B表示的反应的平均速率为0.6 mol/(L·s);③反应达到平衡时,A、B、C的反应速率一定相等;④反应达到平衡时,A、B、C的物质的量均不再变化
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 |
| C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2A+B 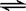 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com