
【题目】两同学为制得纯净的Fe(OH)2,使用如图所示的装置,A管中是Fe和H2SO4,B管中是NaOH溶液:

(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是___________;
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是___________,B中发生反应的离子方程式为____________________________________
(3)在制备纯净的Fe(OH)2实验中,一定要注意避免Fe(OH)2被氧化,一旦实验失败就会看到白色絮状沉淀逐渐变为灰绿色,最后变成红褐色,请写出这个过程的化学方程式,并用单线桥法标出电子转移的方向和数目:_________________________________
【答案】产生红褐色沉淀 有白色沉淀产生 Fe2++2OH-=Fe(OH)2↓ 
【解析】
(1)先夹紧止水夹a,使A管开始反应,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁;
(2)打开a,A中产生的氢气通过a进入B中,排出B中的空气,使A管中反应一段时间后再夹紧止水夹a,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁;
(3) Fe(OH)2在空气中被氧气氧化为Fe(OH)3;铁元素化合价由+2价升高为+3价。
(1)先夹紧止水夹a,使A管开始反应,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,在B管中观察到的现象是产生红褐色沉淀;
(2)打开a,A中产生的氢气通过a进入B中,排出B中的空气,使A管中反应一段时间后再夹紧止水夹a,A中产生的氢气把硫酸亚铁溶液压入B中,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在B管中观察到的现象是有白色沉淀产生,反应的离子方程式为Fe2++2OH-=Fe(OH)2↓;
(3) Fe(OH)2在空气中被氧气氧化为Fe(OH)3,反应方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3;铁元素化合价由+2价升高为+3价,电子转移的方向和数目可表示为 。
。


科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:

(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
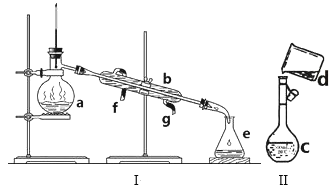
(1)写出下列仪器的名称:a.__ b.__ c.__。
(2)仪器a~e中,使用前必须检查是否漏水的有__。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__,将仪器补充完整后进行实验,温度计水银球的位置在__处。冷凝水由__(填f或g)口通入,__口流出。
(4)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。
①图中的错误是__。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:___。
②根据计算得知,所需NaOH的质量为__g。
③配制时,正确操作顺序是(字母表示,每个字母只用一次)__。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④用“偏大”“偏小”或“无影响”填空
A.配制NaOH溶液,需称量一定质量的溶质,称量时使用了游码,但物码放置颠倒__。
B.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容__。
C.定容摇匀后,发现液面下降,继续加水至刻度线__。
D.定容时仰视刻度线__。
E.容量瓶中原有少量蒸馏水__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的硫酸亚铁固体,利用下图装置进行实验。
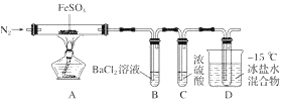
实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是__________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________。
(3)实验④反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的是( )
A. NaOH溶液与盐酸中和B. Zn与CuSO4 溶液的反应
C. 分解氯酸钾制氧气D. MgCl2溶液 与KOH溶液产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种长效、缓释阿司匹林的合成路线如下图所示:
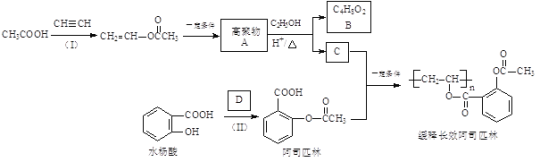
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)
RCOOR"+R′OH(R、R′、R"代表烃基)
(1)结构简式:A______________,B_______________;
(2)反应(Ⅰ)的反应类型为_________________,缓释长效阿司匹林结构中与“缓释作用”有关的官能团的名称为________________。
(3)D为乙酸酐,结构简式为![]() ,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
(4)已知水杨酸酸性主要来源于“![]() ”,阿司匹林中将“
”,阿司匹林中将“![]() ”转化为“
”转化为“![]() ”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
(5)已知:①乙炔与无机酸的反应和反应(Ⅰ)类似;②![]() ,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(
,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(![]() )_________。(合成路线常用的表示方式为:
)_________。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究。查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
I.摩擦剂中氢氧化铝的定性检验,取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量![]() 溶液,过滤。氢氧化铝与
溶液,过滤。氢氧化铝与![]() 溶液反应的离子方程式是___________
溶液反应的离子方程式是___________
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察的现象是__________
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
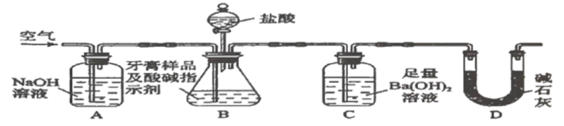
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是_______________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的![]() 气体
气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取![]() 样品三份,进行三次测定,测得
样品三份,进行三次测定,测得![]() 平均质量为
平均质量为![]() 。则样品中碳酸钙的质量分数为_____________________。
。则样品中碳酸钙的质量分数为_____________________。
(7)有人认为不必测定C中生成的![]() 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收![]() 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:

探究一:设计如图所示装置进行“铁与水反应”的实验
(1)硬质玻璃管E中反应的化学方程式为_________
(2)反应前A中投放碎瓷片的目的是_________
(3)装置E中的现象是_________
探究二:设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
实验操作:待硬质玻璃管B冷却后,取少许其中的固体物质溶于稀硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);写出溶液变血红色的离子方程式:____________,若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(5)另一份用_________(填仪器名称),加入_________(填试剂),观察观察到_________(填实验现象),可以证明溶液中存在Fe2+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com