
| 实验 | 现象 | 结论 | |
| A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
| B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
| C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向Ba(NO3)2溶液中通入二氧化硫气体,发生氧化还原反应生成硫酸钡;
B.少量氯水只氧化碘离子;
C.水解后检验葡萄糖,应在碱性条件下;
D.加入少量BaCl2固体,水解平衡逆向移动,碱性降低.
解答 解:A.向Ba(NO3)2溶液中通入二氧化硫气体,发生氧化还原反应生成硫酸钡,结论不合理,故A错误;
B.因还原性亚铁离子大于碘离子,少量氯水只氧化碘离子,结论不合理,故B错误;
C.水解后检验葡萄糖,应在碱性条件下,没有加碱至碱性,不能检验,故C错误;
D.加入少量BaCl2固体,水解平衡逆向移动,碱性降低,溶液红色变浅,证明Na2CO3溶液中存在水解平衡,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握氧化还原反应、有机物的水解、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
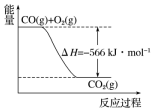 已知:
已知:| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )| A. | 合金的熔点通常比组分金属高,硬度比组分金属小 | |
| B. | 已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2 | |
| C. | 用金属铝与V2O5反应冶炼钒,铝作还原剂 | |
| D. | V原子序数为23,该原子的价电子构型为4S24P1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
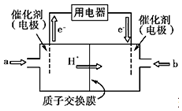 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
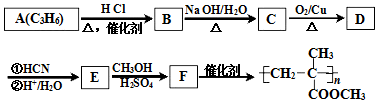
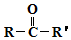 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$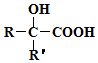 (R'可以是烃基,也可以是H原子)
(R'可以是烃基,也可以是H原子)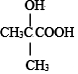 ,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为
,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为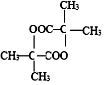 .
. )的合成路线(无机试剂可以任选)
)的合成路线(无机试剂可以任选)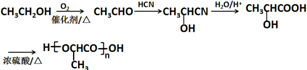 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氢元素的五种核素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2互称为同素异形体 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素 | |
| D. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
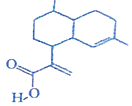
| A. | 该物质属于芳香族化合物 | B. | 该物质易溶于水 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
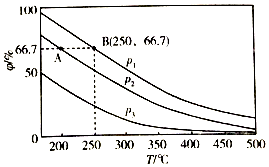 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com