
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
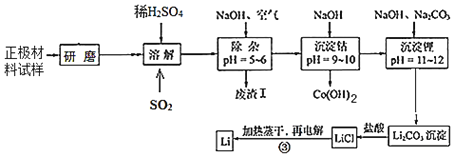
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
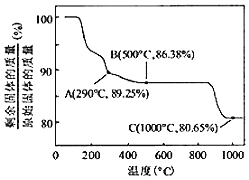
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。
【答案】+3 研磨 将Co 3+还原为Co 2+ 将Fe3+、 Al3+转化为沉淀除去 Co2++2OH﹣=Co(OH)2↓ 热水 抑制LiCl 水解,同时带走水蒸气 CoO
【解析】
正极材料经过研磨后变成粉末状,增大表面积,与稀硫酸反应时能加快反应速率,二氧化硫具有还原性,通入二氧化硫,可将Co 3+还原为Co 2+;根据部分金属氢氧化物开始沉淀和完全沉淀时的pH可知,第一次加入NaOH调pH的目的是将Fe3+、 Al3+转化为沉淀除去;第二次加入NaOH沉淀Co;再次加入NaOH和Na2CO3使Li转化为Li2CO3沉淀;Li2CO3沉淀和盐酸反应生成氯化锂,再经过加热蒸干、电解得到Li单质。
(1)LiCoO2中,Li为+1价、O为﹣2价,则Co元素的化合价为+3,故答案为:+3;
(2)将固体研磨的目的是为加快化学反应速率,故答案为:研磨;
(3)二氧化硫具有还原性,通入二氧化硫,可将Co 3+还原为Co 2+,故答案为:将Co 3+还原为Co 2+;
(4)滤液中含有Fe3+、 Al3+,加NaOH调pH的目的是将Fe3+、 Al3+转化为沉淀除去,故答案为:将Fe3+、 Al3+转化为沉淀除去;
(5)“沉钴”过程中发生反应的离子方程式为Co2++2OH﹣=Co(OH)2↓,故答案为:Co2++2OH﹣=Co(OH)2↓;
(6)温度升高,溶解度降低,则应用热水洗涤,避免碳酸锂溶解,将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是 抑制LiCl 水解,同时带走水蒸气,
故答案为:热水; 抑制LiCl 水解,同时带走水蒸气;
(7)根据质量守恒定律,在变化过程中,Co的质量没有变,假设原始固体质量为100g,则n(Co)=![]() mol,m(Co)=100×
mol,m(Co)=100×![]() g;
g;
在1000℃时,固体质量不再变化,说明Co(OH)2完全分解,n(Co):n(O)=![]() :[(80.65﹣100×
:[(80.65﹣100×![]() )×
)×![]() ]=1:1,剩余固体成分为CoO,故答案为:CoO。
]=1:1,剩余固体成分为CoO,故答案为:CoO。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
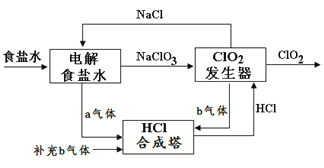
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:ClO3- + 2H+ + e-![]() ClO2↑ + H2O
ClO2↑ + H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充44.8Lb气体(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物M和N的说法正确的是
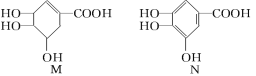
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.N分子中,可能在同一平面上的原子最多有14个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
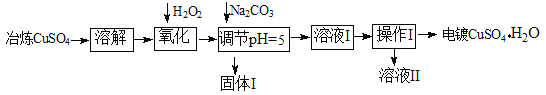
已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.6 g金属钠投入到足量水中,得ag溶液;将4.8 g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为 ( )
A.a=bB.a>b
C.a<bD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列转化过程分析不正确的是

A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+B(g)C(g),△H >0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )
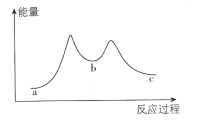
A.由图可知,加入催化剂之后,原反应分成了两步,第一步反应较慢
B.若40s后达到平衡,则用A表示该反应的速率为0.01molL-1min-1
C.当容器c(B)/c(A)不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应:N2(g)+O2(g)![]() 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
A.缩小体积使压强增大______________________________________________________。
B.体积不变充入N2使压强增大________________________________________________。
C.体积不变充入氩气使压强增大_______________________________________________。
D.压强不变充入氩气使体积增大_______________________________________________。
E.增大体积使压强减小_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.化学反应速率关系是:3υ正(H2)= 2υ正(NH3)
C.达平衡后,分离出少量NH3,V正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com