
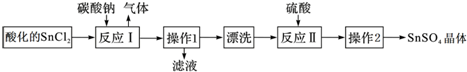
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
分析 SnCl2溶解得到溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体;
A.SnCl2易水解,加入盐酸,抑制Sn2+水解;
B.反应Ⅰ得到沉淀是SnO,Sn元素化合价不变化,同时生成气体,该气体为二氧化碳;
C.洗涤在分液漏斗中进行;
D.由以上分析可知操作1为过滤,操作2为结晶;
解答 解:A.SnCl2易水解,酸化是为了防止溶解时发生水解,故A正确;
B.反应Ⅰ得到沉淀是SnO,Sn元素化合价不变化,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,顾B错误;
C.洗涤在分液漏斗中进行,加蒸馏水洗涤过滤2~3次,故C错误;
D.操作1为过滤,操作2为结晶,故D正确;
故选AD.
点评 本题以SnSO4制备为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、难度中等,对学生的基础知识及逻辑推理有较高的要求.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液加水稀释,$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大 | |
| B. | 在0.1 mol•L一1氨水中滴加0.lmol•L一1盐酸,恰好完全中和时溶液的pH<7 | |
| C. | 向0.lmol/L Na2S03溶液中加人少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | 0.lmol•L一1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
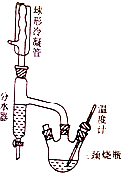 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | 每还原1 mol氧化剂,就有3 mol电子转移 | |
| C. | 还原性:SnCl2>As | |
| D. | 氧化产物和还原产物的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8×10-3mol | B. | 4.4×10-3mol | C. | 3.2×10-3mol | D. | 2.2×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.2mol•L-1 的 NaCl 溶液 | |
| B. | 100mL 0.1mol•L-1 的 NaCl 溶液 | |
| C. | 25mL 0.2mol•L-1 的 Na2SO4 溶液 | |
| D. | 10mL 0.5mol•L-1 的 Na2CO3 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com