
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
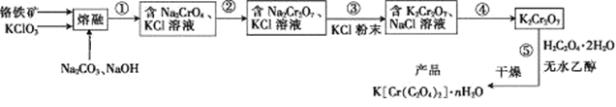
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
【答案】铁 6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3 Al(OH)3和H2SiO3 2CrO42-+2H+= Cr2O72-+H2O 蒸发浓缩 冷却结晶 3
12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3 Al(OH)3和H2SiO3 2CrO42-+2H+= Cr2O72-+H2O 蒸发浓缩 冷却结晶 3
【解析】
铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料,加入氯酸钾、碳酸钠和氢氧化钠在坩埚中熔融发生氧化还原反应,熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤,氧化铁不溶于水,其他物质都为钾盐和钠盐,都可溶于水,则第一次过滤滤渣中的主要成分为Fe2O3;根据步骤①最后得到的为氯化钾和铬酸钠,二是调节所得滤液pH为7~8,加热煮沸半小时,使Na2SiO3、NaAlO2转化为硅酸和氢氧化铝沉淀,趁热过滤。则第二次过滤滤渣的主要成分为Al(OH)3和H2SiO3;过滤后获得含有氯化钾和铬酸钠溶液,调节溶液pH值,加入适量的酸,使溶液中的铬酸钠转化为重铬酸钠,向溶液中氯化钾粉末,转化为重铬酸钾和氯化钠的混合溶液,利用重铬酸钾和氯化钠的溶解度不同,经过蒸发浓缩、冷却结晶、过滤、用无水乙醇对晶体洗涤,再经干燥得到K2Cr2O7晶体。
(1)熔融操作一般在坩埚中进行,由于熔融过程加入氢氧化钠和碳酸钠,高温下可与二氧化硅反应,故不能选用瓷坩埚或SiO2坩埚,应选用铁坩埚。
答案为:铁;
(2) 利用氧化还原反应得失电子守恒,化学方程式为6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑,
12Na2CrO4+3Fe2O3+7KCl+12CO2↑,
答案为:6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑;
12Na2CrO4+3Fe2O3+7KCl+12CO2↑;
(3)步骤①包含两次过滤操作:一是水浸后过滤,氧化铁不溶于水,其他物质都为钾盐和钠盐,都可溶于水,则第一次过滤滤渣中的主要成分为Fe2O3;根据步骤①最后得到的为氯化钾和铬酸钠,二是调节所得滤液pH为7~8,加热煮沸半小时,使Na2SiO3、NaAlO2转化为硅酸和氢氧化铝沉淀,趁热过滤。则第二次过滤滤渣的主要成分为Al(OH)3和H2SiO3;
答案为: Fe2O3;Al(OH)3和H2SiO3;
(4)根据分析,步骤②需加入酸,目的是在酸性条件下,使溶液中的铬酸钠转化为重铬酸钠,则加入稀硫酸时发生反应的离子方程式为2CrO42-+2H+= Cr2O72-+H2O ,
答案为:2CrO42-+2H+= Cr2O72-+H2O;
(5)如图所示,重铬酸钾和氯化钠在一定温度下的溶解度差别较大,经过蒸发浓缩、冷却结晶、过滤,可将重铬酸钾和氯化钠分离,再用无水乙醇对晶体洗涤,再经干燥得到K2Cr2O7晶体。
答案为:蒸发浓缩,冷却结晶;
(6) 已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%,,相对分子质量在数值上等于摩尔质量,则失去的结晶水的摩尔质量分数=![]() =16.8%,解得n=3。
=16.8%,解得n=3。
答案为:3。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
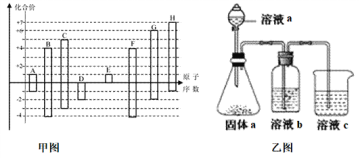
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________(写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式_________________。
(4)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空格。
(1)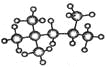 的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
的分子式为:_____________,其一氯代物有_____种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:_____
(2)分子式为C6H14的烃的主链为4个碳的同分异构体共有______种。
(3)写出实验室制取硝基苯的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)海水淡化的方法有_____(选填一种即可)。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。
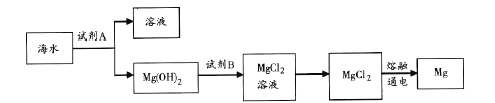
工业上常用于沉淀Mg2+的试剂A 的俗名是___,Mg(OH)2转化为MgCl2 的离子方程式是_______。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2 的途径如下所示:
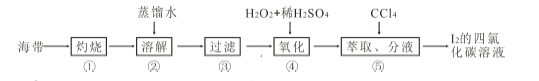
①灼烧海带至灰烬时所用的主要仪器名称是_______。步骤②加热煮沸一会的目的是______________。
② 步骤④向滤液中加H2O2 和稀H2SO4 溶液,写出该反应的离子方程式_______________。反应结束后,再加入CCl4 作萃取剂,振荡、静置,可以观察到CCl4 层呈____________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2F2+2H2O=4HF+O2↑;②AlCl3+3NaHCO3=Al(OH)3↓+3NaCl+3CO2↑ ;③2Na+2H2O=2NaOH+H2↑;④SO2+H2O=H2SO3⑤SO2+Cl2+2H2O=H2SO4+2HCl;⑥NaH+H2O=NaOH+H2↑;⑦CO+H2O![]() CO2+H2;⑧3NO2+H2O = 2HNO3+NO
CO2+H2;⑧3NO2+H2O = 2HNO3+NO
(1)上述反应中不属于氧化还原反应的有(填序号,下同)_____________
(2)H2O被氧化的是_____________;属于氧化还原反应,但H2O既不被氧化,也不被还原的是_____________。
(3)写出⑤的离子反应方程式_____________。
(4)用双线桥法表示反应⑧中电子转移的方向和数目,并指出氧化产物和还原产物。双线桥法:_____________;氧化产物:_____________;还原产物:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiIFePO4)电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池的总反应为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是
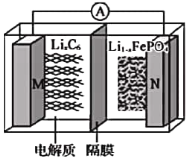
A. 放电时,Li+向M电极移动
B. 充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起
C. 放电时,M电极的电极反应为![]()
D. 充电时,N电极的电极反应为LiFePO4-xe-=xLi++Li1-xFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物用途广泛。某兴趣小组拟制备氯气并验证其一系列性质。
I.(查阅资料)
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
II.(性质验证)
实验装置如图1所示(省略夹持装置)
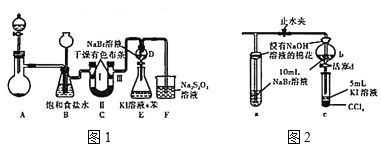
(1)装置A中盛放固体试剂的仪器是____;若分别用KMnO4、Ca(ClO)2、KClO3固体与足量的浓盐酸反应,则产生等量氯气转移的电子数之比为____。
(2)装置C中II处所加的试剂可以是____(填下列字母编号)
A.碱石灰 B.浓硫酸 C.硅酸 D.无水氯化钙
(3)装置B的作用有:除去氯气中的氯化氢、______、_____。
(4)不考虑Br2的挥发,检验F溶液中Cl-需要的试剂有_______。
III.(探究和反思)
图一中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为图2装置,实验操作步骤如下:
①打开止水夹,缓缓通入氯气;②当a和b中的溶液都变为黄色时,夹紧止水夹;
③当a中溶液由黄色变为棕色时,停止通氯气;④…
(5)设计步骤③的目的是______。
(6)还能作为氯、溴、碘非金属性递变规律判断依据的是_____(填下列字母编号)
A.Cl2、Br2、I2的熔点 B.HCl、HBr、HI的酸性
C.HCl、HBr、HI的热稳定性 D.HCl、HBr、HI的还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com