
| A. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 由NaCl制漂白剂:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | 由铝土矿冶炼铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| D. | 合成NH3:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
分析 A.海水制镁,氧化镁熔点高,电解氯化镁制取镁;
B.漂白粉主要成分为氯化钙、次氯酸钙,由NaCl制漂白剂:电解氯化钠溶液制取氯气,氯气和石灰乳反应生成漂白粉;
C.铝土矿主要成分是三氧化二铝,应提纯后再电解;
D.NH4Cl和Ca(OH)2固体加热制取氨气为实验室制取氨气,工业用氮气和氢气合成氨.
解答 解:A.从海水中提取镁,是先制备生石灰与水反应生成熟石灰,生成物是氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀氢氧化镁,加入盐酸溶解氢氧化镁变为氯化镁,浓缩结晶得到氯化镁晶体,在氯化氢气流中加热失水得到氯化镁固体,熔融氯化镁通电分解,反应物是氯化镁,生成物是镁和氯气,MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故A错误;
B.漂白粉主要成分为氯化钙、次氯酸钙,由NaCl制漂白剂:电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,该反应为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,制得漂白粉,故B正确;
C.铝土矿主要成分是三氧化二铝,应提纯后再电解,电解氧化铝制备Al,反应为2Al2O3(熔融)$\frac{\underline{\;\;\;\;\;电解\;\;\;\;\;}}{Na_{3}AlF_{6}}$4Al+3O2↑,故C错误;
D.工业用氮气和氢气合成氨,3H2+N2$?_{催化剂}^{高温高压}$2NH3,NH4Cl和Ca(OH)2固体加热为实验室制取氨气,故D错误;
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与工业生产的考查,有利于培养学生良好的科学素养,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
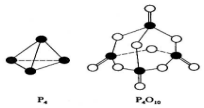 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x>0 a<0 | |
| B. | b<o c<o | |
| C. | x=3a-b-c | |
| D. | 1mol碳(s)在空气中不完全燃烧生成CO的焓变小与akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
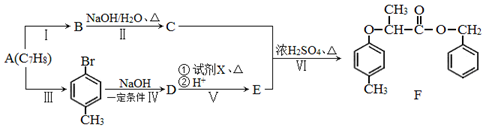
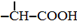 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$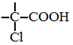
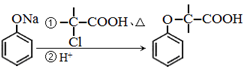
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
.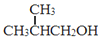 为原料制取
为原料制取 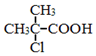 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
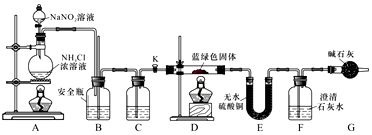
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
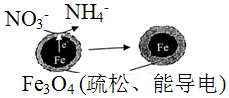
| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的容量瓶可以放进烘箱中烘干 | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出 | |
| D. | 用二硫化碳清洗残留在试管壁上少量的硫粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
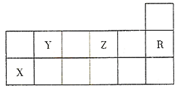
| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | 简单离子半径比较Z小于X | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com