
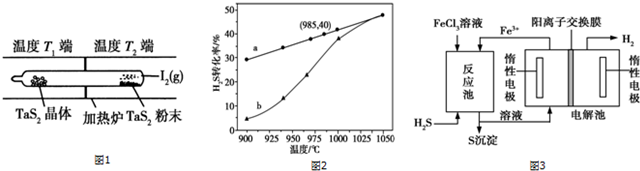
分析 (1)在高温时,将金红石(TiO2)、炭粉混合并通人Cl2先制得TiCl4和一种可燃性气体,是金红石(TiO2)、炭粉混和通人Cl2发生反应生成TiCl4和一种可燃性气体为CO,利用盖斯定律,将热化学方程式进行运算得到所需热化学方程式;
(2)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,平衡常数计算式可知平衡浓度可以利用物质的量代替直接计算平衡常数,所以带入K值可以得出转化率x;
通过题意可知温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)①由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快;
②电解池中亚铁离子失去电子,氢离子得到电子,反应生成铁离子和氢气,以此来解答.
解答 解:(1)①TiO2 (s)+2Cl2(g)═TiCl4(1)+O2(g);△H=-410.0kJ•mol-1
②CO(g)═C(s)+$\frac{1}{2}$O2(g);△H=+110.5kJ•mol-1
依据盖斯定律内容用上述热化学方程式计算,①-②×2得到则上述反应的热化学方程式是:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;高温\;}}{\;}$TiCl4(l)+2CO(g)△H=-631kJ/mol,
故答案为:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;高温\;}}{\;}$TiCl4(l)+2CO(g)△H=-631kJ/mol;
(2)K=1,设 I2的平衡转化率为x,则参加反应的I2为xmol,
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H1>0
起始量(mol) 1 0 0
变化量(mol) x 0.5x 0.5x
平衡量(mol) 1-x 0.5x 0.5x
平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,体积为15ml,结合平衡常数计算式可知,平衡浓度可以用物质的量代替来计算平衡常数,则根据K=$\frac{[Ta{I}_{4}][{S}_{2}]}{[{I}_{2}]^{2}}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,
解之得:x=66.7%,
由所给方程式可知该反应为吸热反应,通过题意可知温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,其中I2是可以循环使用的物质,
故答案为:66.7%;<;I2;
(3)①以H2S起始浓度均为cmol•L-1测定H2S的转化率,由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需的进间缩短;
②电解池中亚铁离子失去电子生成铁离子,氢离子得到电子生成氢气,电解总反应的离子方程式为2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑,
故答案为:2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑.
点评 本题主要考查了盖斯定律及其以硫化氢为载体考查物质的性质、影响反应速率的因素、化学平衡、电化学等,题目综合性强,难度较大,注重了高考常考考点的考查,注意知识的迁移应用和信息的处理.


科目:高中化学 来源: 题型:选择题
| A. | 加热NH4Cl只破坏离子键 | |
| B. | 4.48L氨气中含有0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间不可能形成离子化合物 | |
| C. | 气体分子间一定存在分子间作用力,但分子内不一定含共价键 | |
| D. | 两种不同的非金属元素形成的化合物只存在极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;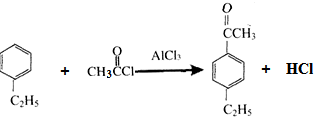 ,④的反应类型是加成反应;
,④的反应类型是加成反应;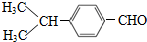 (写结构简式);
(写结构简式); 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 盛装NaOH溶液的试剂瓶不用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| C. | NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


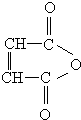 .
.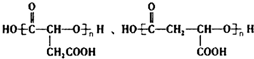 .
.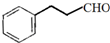 )与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身).
)与F的相对分子质量相同,其中满足下列条件的X的同分异构体有14种(含X本身). 的最简合成线路.
的最简合成线路.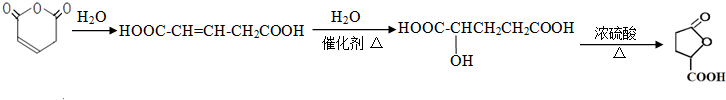 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和AgCl、AgBr的混合溶液中c(Cl-)/c(Br-)=360 | |
| B. | 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 向含有AgCl的饱和溶液中加入少量水后,c(Cl-)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com