
| A. | 金属钠与水的反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中2c(Na+)=c(SO42-) | B. | 0<沉淀的物质的量<$\frac{a}{2}$ mol | ||
| C. | 沉淀的物质的量$\frac{a}{2}$ mol | D. | 原溶液中c(H2SO4)=$\frac{a}{2}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )
,该环上的二溴代物有9种同分异构体,由此推断该环上的四溴代物的同分异构体数目有( )| A. | 4种 | B. | 9种 | C. | 12种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容,充入He | D. | 恒压,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜是负极 | |
| C. | 铜铁原电池工作时,若有2.8 g铁被溶解,电路中就有0.15mol电子通过 | |
| D. | 由镁、铝作电极与NaOH溶液构成的原电池中铝是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
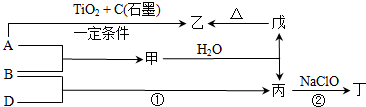
 →
→ ,.
,.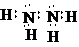 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com