
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是__________________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO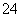 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为163,钴的化合价为________。制备X的化学方程式为________________________;X的制备过程中温度不能过高的原因是________________________。
解析:(1)若没有A中的安全管,当A中产生气体时,会因装置压力过大发生危险,反之,有安全管存在,当A中压力过大时,安全管中的液面会上升,使A瓶中压力稳定。
(2)由题意知,用NaOH标准溶液滴定过剩的HCl时,NaOH溶液应放入碱式滴定管中,可使用酚酞作指示剂,滴定至终点时溶液由无色变为浅红色。
(3)已知盐酸的总的物质的量为c1 mol·L-1×V1 mL×10-3 L·mL-1=c1V1×10-3 mol,NH3反应完后剩余的盐酸用NaOH标准溶液滴定,可求出剩余的盐酸为c2×V2×10-3 mol,由NH3+HCl===NH4Cl可求出NH3的物质的量。进而求出w g X中的含氨量,即: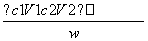 ×100%。
×100%。
(4)若装置气密性不好,会有NH3外逸,而不被HCl吸收,则剩余的HCl的物质的量会增多,消耗NaOH增多,即c2V2的值增大,由(3)中计算式可知氨的测定结果偏低。
(5)AgNO3是见光易分解的物质,使用棕色滴定管的目的是防止AgNO3分解而影响实验结果;由Ag2CrO4的溶度积常数Ksp=1.12×10-12,c(Ag+)=2.0×10-5 mol·L-1,可求出c(CrO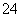 )=
)=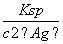 =
=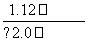 mol·L-1=2.8×10-3 mol·L-1。
mol·L-1=2.8×10-3 mol·L-1。
(6)样品X中钴、氨和氯的物质的量之比为163,可写出化学式为[Co(NH3)6]Cl3,由化合物中正负化合价代数和为0计算,NH3整体为0价,氯为-1价,故Co为+3价;从而推出制备X的化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O。由于温度过高时H2O2易分解,NH3易挥发,故制备过程中温度不能过高,否则H2O2分解,NH3挥发。
答案:(1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
(2)碱 酚酞(或甲基红)
(3)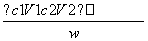 ×100%
×100%
(4)偏低
(5)防止硝酸银见光分解 2.8×10-3
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2===
2[CO(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
点拨:知识:酸碱中和滴定实验,实验的安全性,实验中的计算问题以及误差分析问题,溶度积的利用,化学方程式的书写。钝力:利用实验中给出的数据写计算式并进行误差分析的能力,利用所给出的条件书写化学方程式的能力,能够根据反应物选择合适的反应条件的能力。试题难度:较大。


科目:高中化学 来源: 题型:
已知硫醇RSH能和NaOH反应生成RSNa。化合物
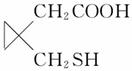 G( )是合成治疗哮喘的药物MK-0476的中间体,其合成路线如
G( )是合成治疗哮喘的药物MK-0476的中间体,其合成路线如
下:
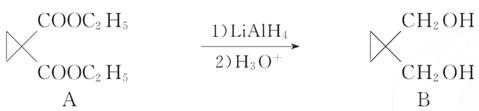
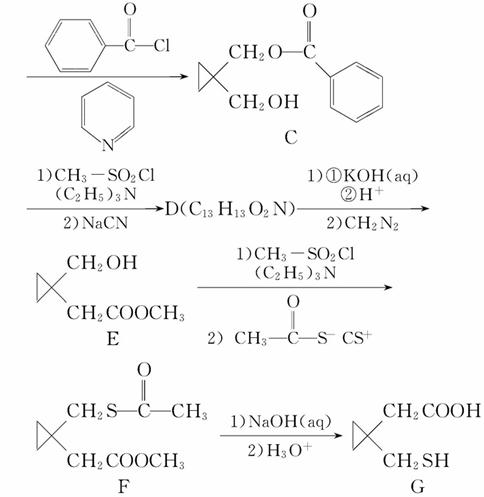
(1)B→C的反应中还可能生成一种有机副产物,该副产物的结构简式为___________________________________________________________;
(2)写出符合下列条件的C的一种同分异构体的结构简式_________;
a.属于芳香族化合物;
b.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
c.水解后的产物才能与FeCl3溶液发生显色反应;
d.不能发生银镜反应。
(3)写出D的结构简式________________________________________;
(4)F→G的转化中,F和足量NaOH溶液反应的化学方程式为____________;
(5)硝化甘油(三硝酸甘油酯)是临床上常用抗心率失常药。该药可以1-丙醇为原料合成制得。请写出合成流程图并注明反应条件。
提示:①合成过程中无机试剂任选,②碳碳双键相邻碳原子上的氢原子具有特殊活性,易在加热条件下与卤素单质发生取代反应,③合成反应流程图表示方法示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
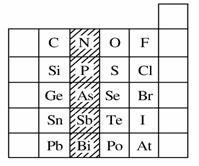
如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是
A.N元素为第一周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不能达到目的的是( )
A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸
B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性
C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡
D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列实验事实所得出的结论或给出的解释正确的是( )
| 实验事实 | 结论或解释 | |
| A | 将40 g NaOH溶于1 L蒸馏水中 | 该溶液中溶质的质量分数为3.84%,其物质的量浓度为1 mol·L-1 |
| B | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 | 还原性Al<Cu |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| D | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,两种物质间反应均产生1 mol气体时,参加反应的酸的物质的量最少的是( )
A.碳与浓硝酸 B.铜与浓硫酸
C.锌与稀硫酸 D.二氧化锰与浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
设由Na2CO3·10H2O和NaHCO3按一定比例组成的混合物为R。现取m g R溶于水,配制成200 mL溶液,由实验测得该溶液中的c(Na+)=0.50 mol·L-1。若将2m g的R加热至质量不再改变时,得到的固体质量为( )
A.10.60 g B.7.95 g
C.5.30 g D.2.65 g
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物 的正确命名为( )
的正确命名为( )
|
| A. | 2﹣乙基﹣3,3﹣二甲基戊烷 | B. | 3,3﹣二甲基﹣4﹣乙基戊烷 |
|
| C. | 3,3,4﹣三甲基已烷 | D. | 2,3,3﹣三甲基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
)惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:

试回答下列问题:
(1)A的结构简式为__________________;F的结构简式为__________________。
(2)反应②中所加的试剂是____________;反应⑤的一般条件是____________。
(3)反应③的化学方程式为____________________________________________。
(4)上述合成路线中属于取代反应的是________________(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com