
| A、元素C的氧化物对应的水化物都是强酸 |
| B、元素B能与A的最高价氧化物发生置换反应 |
| C、C的单质能溶于A与C形成的化合物中 |
| D、D的单质有毒,有漂白性 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
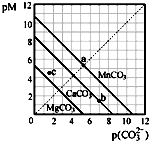 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pc (CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pc (CO32-)=-lg c(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次增大 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示CaCO3 的饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节能、低碳、新能源的提倡主要是应对能源危机,与环境保护基本无关系 |
| B、开发新能源、发展风电、核能、太阳能等是减少矿物能源的依赖 |
| C、低碳的核心内容实际上包括各种形式节能减排、发展新能源减少CO2的排放和减少空气的污染 |
| D、风电属于再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
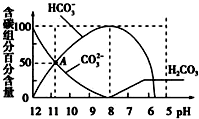 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、0.05mol/L NaHCO3溶液的pH=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈无色 | Fe+NO3-+4H+═Fe3++NO↑+2H2O Fe+2Fe3+═3Fe2+ |
| B | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | 避免晶体颗粒受热不均匀,发生崩裂而飞溅出蒸发皿 | |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | 溶液分层,上层呈橙红色,下层无色 | 避免上层液体再混入下层液体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13 | B、14 |
| C、15 | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢元素被氧化,碳元素被还原 |
| B、HCN是氧化剂,CaCO3是还原剂 |
| C、CaCN2是氧化产物,H2为还原产物 |
| D、CO为氧化产物,H2为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com