
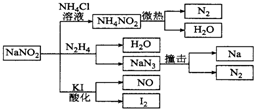
| A. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI-淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2转移6 mole一 |
分析 A.实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制备氮气;
B.根据氧化剂是化合价升高的反应物分析;
C.根据信息可知:NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,而NaCl无氧化性;
D.根据NaN3中氮的化合价为-$\frac{1}{3}$,生成1个 N2转移$\frac{2}{3}$个电子分析.
解答 解:A.采用固液加热制取气体的方法,实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制备氮气,NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O,故A正确;
B.NaNO2与N2H4反应生成NaN3,NaNO2是中氮的化合价由+3价降低为-$\frac{1}{3}$,NaNO2是氧化剂,故B正确;
C.NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,NaCl无氧化性,在酸性条件下不能氧化碘化钾,所以可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2,故C正确;
D.NaN3中氮的化合价为-$\frac{1}{3}$,生成1个N2转移$\frac{2}{3}$个电子,则每产生1molN2转移$\frac{2}{3}$mole-,故D错误;
故选D.
点评 本题主要考查了亚硝酸钠的性质和氧化还原的知识,难度不大,注意抓住题目信息来解题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向等体积的①、②溶液中分别加水稀释100倍后,溶液的pH:①<② | |
| B. | 将等体积的①、③溶液分别与足量铝粉反应,生成H2的物质的量相等 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: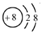 | |
| C. | 水分子的电子式: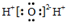 | |
| D. | 乙醛的结构简式:CH3COH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
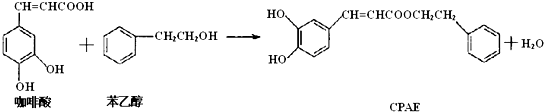
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 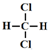 和 和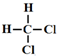 | B. | CH2=CH-CH=CH2和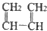 | ||
| C. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | D. | 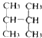 和 和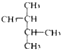 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com