
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)①根据平衡常数表达式来确定它们之间的关系;
②控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
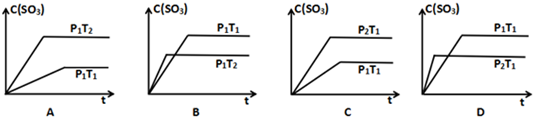
(4)由图象可知,聚合氯化铁的浓度在18~20 mg•L-1时,去除率达到最大值,污水的浑浊度减小.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-1mol•L-1,则溶液pH=-lg1.0×10-1=1,
故答案为:2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)①化学平衡常数等于各个生成物平衡浓度系数次幂之积和各个反应物平衡浓度系数次幂之积的比值,得到常数之间的关系是Ksp=$\frac{Kw3}{K1•K2•K3}$,故答案为:Ksp=$\frac{Kw3}{K1•K2•K3}$;
②控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;
故答案为:bd;
(4)由图象可知,聚合氯化铁的浓度在18~20 mg•L-1时,去除率达到最大值,污水的浑浊度减小,
故答案为:18~20.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
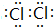 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com