
| A. | KCl溶液 | B. | KClO3 | C. | NaCl晶体 | D. | 氯水 |
分析 KCl、NaCl都属于离子化合物,则氯化钠溶液、氯化钾晶体中都含有氯离子;氯水中,氯气与水反应生成氯化氢和次氯酸,HCl在溶液中能够电离出氯离子;而KClO3中含有钾离子和氯酸根离子,不存在氯离子,据此进行解答.
解答 解:A.KCl溶液中存在氯化钾电离出的钾离子和Cl-,故A错误;
B.KClO3含有的离子为钾离子和氯酸根离子,不存在Cl-,故B正确;
C.NaCl属于离子化合物,氯化钠晶体中含有钠离子和Cl-,故C错误;
D.氯水中,氯气与水反应生成HCl和HClO,则氯水中含有HCl电离出的Cl-,故D错误;
故选B.
点评 本题考查了常见化合物组成,题目难度不大,明确常见化合物类型、电离情况为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
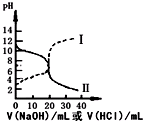 25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示(已知:醋酸铵溶液呈中性).下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 曲线Ⅰ:滴加溶液到10 mL时:2 c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液>20 mL时一定符合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 滴加过程中,当pH=7时滴加的两种溶液体积都在10-20 mL之间,但不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
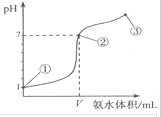 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )| A. | 用0.1mol/LNa0H溶液代替氨水滴定盐酸达到点②时所消耗的Na0H的体积也是VmL | |
| B. | 从开始滴定后的任意一点:溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 从点①到点③的滴定过程中:水的电离程度都增大 | |
| D. | 在点②所示溶液中:c(Cl-)=c(NH4+)>c(H+),且V=20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
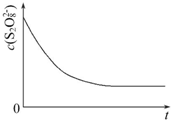 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
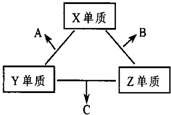 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
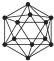 原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60在熔融状态下能够导电,所以K3C60是电解质 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | 胶体和溶液的本质区别在于能否发生丁达尔现象 | |
| D. | 变化过程中化学键被破坏,则一定发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com