

分析 (1)I中均与盐酸反应生成二氧化碳,石灰水均变浑浊;而Ⅱ中均与盐酸反应生成气体,但气球变大的快慢不同;
(2)图Ⅲ、Ⅳ均为加热法鉴别,碳酸氢钠加热分解生成碳酸钠;
(3)与实验Ⅲ相比,实验Ⅳ操作简单,对比性高;
(4)石灰水变浑,是因二氧化碳与石灰水反应生成碳酸钙;
(5)碳酸氢钠不稳定,便于对比可使碳酸氢钠受热温度低.
解答 解:(1)I中均与盐酸反应生成二氧化碳,石灰水均变浑浊;而Ⅱ中均与盐酸反应生成气体,但气球变大的快慢不同,则Ⅱ可鉴别,故答案为:Ⅱ;
(2)图Ⅲ、Ⅳ均为加热法鉴别,碳酸氢钠加热分解生成碳酸钠,反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)与实验Ⅲ相比,实验Ⅳ操作简单,对比性高,只有D符合,故答案为:D;
(4)石灰水变浑,是因二氧化碳与石灰水反应生成碳酸钙,石灰水变浑反应的离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(5)碳酸氢钠不稳定,便于对比可使碳酸氢钠受热温度低,则试管B中装入物固体最好是NaHCO3,故答案为:NaHCO3.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异及反应与现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

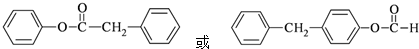 .
. $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$ .化合物
.化合物  是合成抗癌药物美发伦的中间体,请写出以
是合成抗癌药物美发伦的中间体,请写出以  和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、O
、O 、Ca
、Ca .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1mol Na2O2固体中含离子总数为3NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com