
| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、CO32-、NO3- | ||
| C. | Na+、Ag+、SO42-、Cl- | D. | Al3+、Fe3+、NO3-、SO42- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
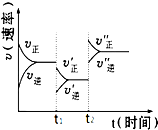 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A. | t1时,降低了温度 | |
| B. | t2时,加了催化剂 | |
| C. | t2时,增大了压强 | |
| D. | t1时,减小了A或B的物质的量的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
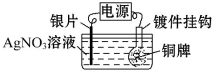
| A. | 通电后,Ag+向阳极移动 | |
| B. | 银片与电源负极相连 | |
| C. | 该电解池的阴极反应可表示为Ag++e-═Ag | |
| D. | 当电镀一段时间后,将电源反接,铜牌可恢复如初 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
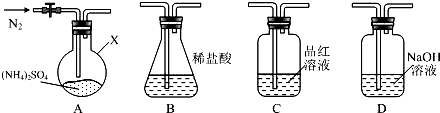
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
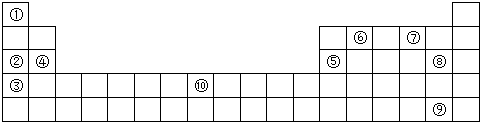
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com