
����Ŀ��ij����С������ʵ��������95mL1.0mol/L��������Һ��Ȼ�����о�����ͭ������ķ�Ӧ�����
��1������95mL1.0mol/L��������Һ����Ҫ���������ձ�������������Ͳ����ͷ�ι��⣬����Ҫ�IJ���������_____________��
��2������10mol/L��Ũ����������������Һ����Ҫ��ȡŨ����������_________mL��
��3�����ƹ����У����в���������Ũ��ƫС����________��
A,.����ҡ������Һ����ڿ̶��ߣ��ټ�ˮ���̶���
B.����ʱ��������ƿ�Ŀ̶���
C.����Һת������ƿ����û��ϴ���ձ��Ͳ��������ͽ��ж��ݲ���
D.����ƿ������ˮϴ�Ӻ�δ���
E.��ȡŨ�����������������ˮϴ����Ͳ����ϴ��ҺҲ�����ձ�
��4������С��ͬѧ���Ƶõ�������ͭƬ������װ���з�Ӧ����Ӧ���ڹ۲쵽���Թ��е�Һ��a��Ϊ��ɫ���Թ��Ϸ���dz����ɫ������֡�
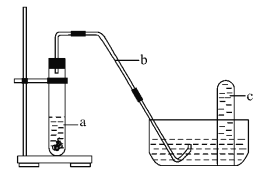
����Ӧ����Һ��a��Ϊ��ɫ�����ڷ�Ӧ������_________(�ѧʽ)��
������ͷ�Ӧ�����Թ��Ϸ���dz����ɫ������ֵ�����_________ (��ϻ�ѧ����ʽ˵��)��
�����º���ɫ�������Թ�c����ɫ��ʧ�ķ�Ӧ����ʽΪ_________��
���𰸡� 100mL����ƿ 10.0 AC Cu(NO3)2 װ�����п�������NO��������Ϊ����ɫ��NO2 ���壬2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
����������1��ʵ����û��95mL��������ƿ����������100mL������100mL1.0molL-1��������Һ����Ϊ�����㡢�������ܽ���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���õ��IJ��������У��ձ�����������100ml����ƿ����ͷ�ιܣ�������Ҫ�IJ�����������100mL����ƿ����2������100mL1.0molL-1��������Һ������Ҫ10molL-1��Ũ�������ΪV����������Һϡ���������ʵ����ʵ�������ã�100mL��1.0molL-1=10molL-1��V�����V=10mL����3��A������ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߣ�������Һ���ƫ����ҺŨ��ƫ�ͣ�ѡ��Aѡ��B������ʱ��������ƿ�Ŀ̶��ߣ�������Һ���ƫС����ҺŨ��ƫ�ͣ�ѡ��B��ѡ��
C������Һת������ƿ��û��ϴ���ձ��Ͳ��������ͽ��ж��ݲ��������²���������ģ����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ�ѡ��Cѡ��D������ƿ������ˮϴ�Ӻ�δ��ɣ������ʵ����ʵ�������Һ�����������Ӱ�죬��ҺŨ�Ȳ��䣬ѡ��D��ѡ��E.��ȡŨ���������������ˮϴ����Ͳ����ϴ��ҺҲ�����ձ������൱����������ƫ�࣬����������ҺŨ��ƫ��ѡ��E��ѡ����ѡAC����4����ͭ�����ᷴӦ��������ͭ����ѧʽΪCu(NO3)2����װ�����п�������NO��������Ϊ����ɫ��NO2 ���壬2NO+O2 = 2NO2����ʹ��ʼû��NO2��ֻ��NO����Ҳ���ܱ�ɺ���ɫ����Ӧ�����Թ��Ϸ���dz����ɫ������֣�
�۶��������ܹ���ˮ��Ӧ���������һ����������Ӧ����ʽ��3NO2+H2O = 2HNO3+NO�����Ժ���ɫ�������Թ�c����ɫ��ʧ��
�㾦�����⿼����һ�����ʵ���Ũ����Һ�����Ƽ���������̽������ȷ����ԭ�����������裬��Ϥ����������ǽ���ؼ����״���Ϊ��4����ͭ�����ᷴӦ��������ͭ������ͭΪ��ɫ��Һ��������һ�������ܹ��������������Ӧ���ɶ���������𣻢����ݶ��������ܹ���ˮ��Ӧ���������һ���������
�����͡�������
��������
29
����Ŀ��ij��ˮ�к���CN-��Cr2O72-���������辭��ˮ��������С���ŷ�����ˮ����������������̽��д���:
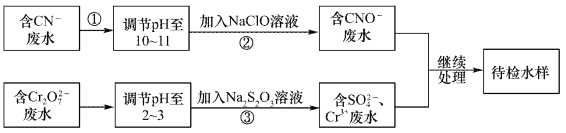
�ش���������:
��1������������CN-��ClO-����ΪCNO-�����ӷ���ʽΪ____________��
��2���������ķ�Ӧ�����˷���ʽΪS2O32-+Cr2O72-+H+��SO42-+Cr3++H2O(δ��ƽ)��ÿ����0.4mol Cr2O72-ʱ����Ӧ��S2O32-ʧȥ_________mol���ӡ�
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ����___________________��
���𰸡� CN��+ClO�� = CNO��+Cl�� 2.4 ���ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ
����������1��������У�CN-��ClO-����ΪCNO-����Ϊ���ڼ��Ի����У�����ClO��ֻ�ܱ���ԭΪCl������˷�Ӧ�����ӷ���ʽΪCN��+ClO�� = CNO��+Cl������2�����ݷ���ʽ��֪���ڷ�Ӧ��CrԪ�صĻ��ϼ۴ӣ�6�۽��͵���3�ۣ��õ�3�����ӣ�����0.4 mol Cr2O72-ת��ΪCr3��ʱת�Ƶ��ӵ����ʵ�����0.4mol����6��3����2��2.4mol����3����ʯ����ǿ�����ˮ�Լ��ԣ����Ժ�Cr3+��ˮ�м�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮpH��ʹ��ת��ΪCr(OH)3������ȥ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͼ���������������У���ȷ����( )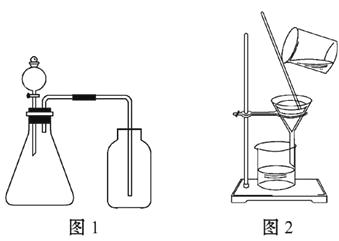
A.ͼ1��ʾװ�ÿ����ڷֱ���ȡ����NO��H2
B.ͼ1��ʾװ�ÿ�������֤�����ԣ�KMnO4��Cl2
C.ϴ�ӳ���ʱ(��ͼ2)����©���м�����ˮ�����貢�˸�
D.����ͼ2��ʾ�ķ��������ᴿ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ըɺ���Ϊԭ����ȡ�ⵥ�ʺ��Ȼ��صĹ���Ҫ������,���������ա�
��1������һ�����ոɺ���,ʹ��һ�������ˮ���ݹ���,�Ƶ�ԭ��Һ,�����Ȼ��ص����ʡ�ʵ�������պ���Ӧ����___________(��д��������)��
��2�������:ԭ��Һ���ᾧ���˷�����Ȼ��غ�,����Һ��ͨ������������I�����Ƶø�����Һ��ͨ��������������Ӧ�����ӷ���ʽΪ___________________________��
��3��������:ȡl00mL������и�����Һ,���������̷���ⵥ�ʡ�

�ữ���̷����ķ�Ӧ��:5I��+IO3��+6H+=3I2+3H2O������ȡ�����ķ�Ӧ���ӷ���ʽΪ_________________________________________________________________________��
��ȡ��XӦѡ��____________________��ѡ���)��
a.100mL�� b.10mL�Ҵ� c.10mLCCl4
����I��������______________________________��
(4)�����һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ���:___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ԭ��ز����ĵ�ѹ������ǿ�Ⱦ��������⡢���Ҫ��Ϊ���뻯���١���Ϊ��װ���еĵ缫��š�����˵���������(����)
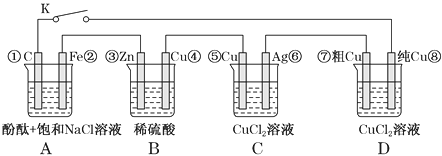
A. ��K�Ͽ�ʱ��Bװ��пƬ�ܽ⣬����������
B. ��K�պ�ʱ��Aװ�÷���������ʴ���ڵ�·������Դ
C. ��K�պϺ�Cװ�ÿ���Ϊ��Ƴ�װ��
D. ��K�պϺ�A��Bװ����pH���C��Dװ����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ȼ���������ͭ�����Һ����ֽ�ϲ�������ʵ�飬ʵ��װ����ͼ��ʾ��![]()
��ش��������⣺
��1���Թ�������չ��������Ҫ�ɷ�����
��2�������������ʵ��Ĺؼ�������������һ����ʱӦע����
��3����������������Ӧ������ɫ��Ӧ����ʵ���ð�ˮ��Ϊ��ɫ�Լ���д����ʵ���н�����ɫ��Ӧ�IJ�����������
��4����ɫ��Ӧ�ɹ۲쵽��д����ɫ��Ӧʱ��������Ӧ�����ӷ���ʽ����
��5����Ҫ�������ʼ�Ѫ���Ƿ�����Ԫ�أ�ʵ������������£�
��ȡ2mL���ʼ�Ѫ���������ྻ���������У�����2mL2mol��L��1HNO3��Һ�����Ȳ����Ͻ��衣
�ڽ�������Һ���ɣ��õ������ĩ��
��ȡ���������ĩ����������ϡ�����У����Լ�A���۲������ж�������Ԫ�ش��ڡ�
�����ٵĻ�ѧԭ���������о�һ�ֿ����ڲ��������Լ�A��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3 �� Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������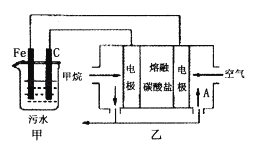
A.Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2
B.��װ���������ķ�ӦΪFe��2e���TFe2+
C.Ϊ��������ˮ�ĵ���������Ӧ����ˮ������������NaOH��Һ
D.����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ4.48 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��绯ѧ��ʴ��������װ����ͼ��ʾ�������й�˵��������ǣ� �� 
A.dΪʯī����Ƭ��ʴ�ӿ�
B.dΪʯī��ʯī�ϵ缫��ӦΪ��Na++e���TNa
C.dΪп�飬��Ƭ���ױ���ʴ
D.dΪп�飬��Ƭ�ϵ缫��ӦΪ��2H++2e���TH2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.�����백ˮ��Ӧ��CH3COOH+NH3?H2O�TCH3COO��+NH4++H2O
B.������ˮ��Ӧ��Cl2+H2O�T2H++Cl��+ClO��
C.�Ƹ�ˮ��Ӧ��Na+2H2O�TNa++2OH��+H2��
D.����ͭ��Һ������������Һ��Ӧ��Ba2++SO ![]() �TBaSO4��
�TBaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫϡ��ҺX�У����ܺ����±����������е�ij���֣�
������ | CO32����SiO32����AlO2����Cl�� |
������ | Al3+��Fe3+��Mg2+��NH4+��Na+ |
��ȡ����Һ�����������м���ij�Լ�Y���������������ʵ�����n��������Լ������V���Ĺ�ϵ��ͼ��ʾ��
��1����Y�����ᣬ��oa��ת��Ϊ���������ӣ�ָ��Դ��X��Һ�ģ���ͬ���� �� ab�η�����Ӧ�������� �� bc�η�����Ӧ�����ӷ���ʽΪ ��
��2����Y��NaOH��Һ����X��һ�����е��������� �� �����ʵ���֮��Ϊ �� ab�η�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com