
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:分析 (1)原子总数相等价电子总数相等的微粒互为等电子体;
(2)物质熔沸点:原子晶体>离子晶体>分子晶体;
(3)同主族自上而下元素第一电离能增大;
(4)Se为34号元素,根据核外电子排布规律书写;
(5)计算S原子价层电子对数、孤电子对数,确定其杂化方式及空间构型;
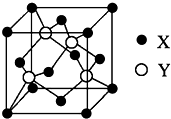
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
解答 解:(1)原子总数相等价电子总数相等的微粒互为等电子体,与CO2等电子的化合物为N2O等;
故答案为:N2O等;
(2)Na2O是离子晶体、SiO2是原子晶体、P2O5属于分子晶体,故熔沸点:SiO2>Na2O>P2O5,
故答案为:SiO2>Na2O>P2O5;
(3)同主族自上而下元素第一电离能增大,故第一电离能:O>S>Se,
故答案为:O>S>Se;
(4)Se为34号元素,核外电子排布式为:[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4;
(5)SO32-离子中硫原子的孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数为3+1=4,故S原子采取sp3杂化,该离子的立体构型为:三角锥形,
故答案为:sp3;三角锥形;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
①在一个晶胞中,X离子的数目8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Y离子数目为4,该化合物的化学式为ZnO,
故答案为:4;ZnO;
②水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子之间形成氢键;
③SO42-中S原子孤电子对数为$\frac{6+2-2×4}{2}$=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4,
故答案为:正四面体;CCl4或SiCl4;
④X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
点评 本题是对物质结构与性质的考查,涉及等电子体、熔沸点比较、电离能、核外电子排布、杂化方式与空间构型判断、晶胞计算、氢键、配合物、化学键等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2 | |
| B. | 因为Mg可以与水反应放出H2,所以Ca也可以与水反应放出H2 | |
| C. | 因为CO2的水溶液可以导电,所以CO2是电解质 | |
| D. | 因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
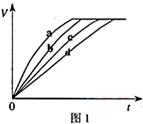 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能 | 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| A | 2.0 | 25 | 块状 |
| B | 2.5 | 30 | 块状 |
| C | 2.5 | 50 | 粉末状 |
| D | 2.5 | 50 | 块状 |
| A. | D-C-A-B | B. | C-D-B-A | C. | A-B-C-D | D. | A-B-D-C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31.0kJ/mol | B. | -665.6kJ/mol | C. | 332.8 kJ/mol | D. | -31.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
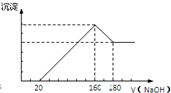 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g) 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.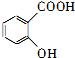 .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$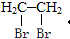
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.2NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com