
| A. | 氯水应保存在棕色瓶中,久置的氯水,pH值减小 | |
| B. | 新制饱和氯水中存在4个平衡 | |
| C. | 在一定浓度的氯水中加小苏打,$\frac{c(HClO)}{c(C{l}^{-})}$不变 | |
| D. | 饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
分析 氯水中,氯气与水发生Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,以此解答.
解答 解:A.氯水中的次氯酸见光易分解,生成HCl和O2,酸性增强,pH减小,所有要保持在棕色瓶中,故A正确;
B.氯水中存在H2O?H++OH-,Cl2+H2O?HCl+HClO,HClO?H++ClO-三个平衡状态,故B错误;
C.氯水中含有一定量浓度的盐酸,能与小苏打生成CO2气体,所以平衡Cl2+H2O?HCl+HClO正向移动,但两者物质的量是按1:1增加,所以$\frac{c(HClO)}{c(C{l}^{-})}$不变,故C正确;
D.氯水中存在平衡:Cl2+H2O?HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,故D正确.
故选B.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②④⑤ | C. | ①③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
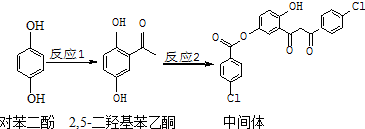
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯碱溶液中加入苯酚:CO32-+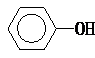 → →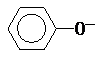 +HCO3- +HCO3- | |
| B. | 小苏打溶液中加醋酸溶液:HCO3-+CH3COOH→CO2↑+CH3COO- | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH-→AlO2-+2H2O | |
| D. | 氯化铵溶于水:NH4++2H2O?H3O++NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
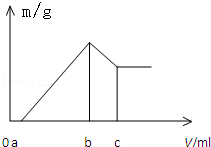 将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:
将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
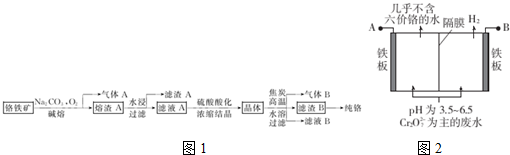
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为10NA | |
| C. | 22.4 L氨气中含有N-H键的个数为3NA | |
| D. | Fe与水蒸气在高温条件下反应,有1mol Fe参与反应,则转移电子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
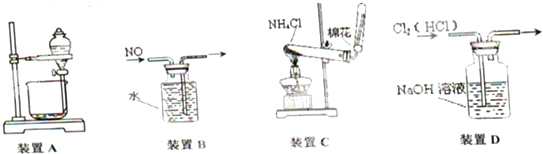
| A. | 用装置A分离乙酸和乙酸乙酯 | B. | 用装置B收集NO气体 | ||
| C. | 用装罝C在实验室中制取氨气 | D. | 用装置D除去Cl2中的HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com