
 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)阳极氧化法制Cu2O,铜失去电子,根据电荷守恒,溶液中有氢氧根离子参与反应,离子交换膜需允许氢氧根离子通过,铜网作阳极,与电源的正极相连;
(2)根据盖斯定律知,目标反应相当于②-③×8+①×4;
(3)①该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气的转化率增大;
②先计算水蒸气反应速率,再根据同一反应中同一段时间内各物质的反应速率之比等于其计量数之比计算氧气反应速率;
③研究催化剂对反应速率的影响,只能让催化剂作为变量,其余的均相同.
解答 解:(1)阳极氧化法制Cu2O,铜失去电子,根据电荷守恒,溶液中有氢氧根离子参与反应,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,离子交换膜需允许氢氧根离子通过,过为阴离子交换膜;铜网作阳极,与电源的正极相连,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;阴;正;
(2)目标反应为8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g),根据盖斯定律知,目标反应相当于②-③×8+①×4,故△H=(-846.3)+[-(157)×8]+(-169)×4=-266.3kJ/mol,
故答案为:8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g)△H=-266.3kJ/mol;
(3)①因为该反应的正反应方向为吸热方向,升温,平衡正向移动,平衡常数增大,③的平衡常数大于①,所以T2>T1,
故答案为:>;因为该反应的正反应方向为吸热方向,升温,平衡正向移动,平衡常数增大,③的平衡常数大于①,说明T2大于T1;
②前20min内水蒸气反应速率=$\frac{0.050-0.0486}{20-0}$mol/(L.min)=7×10-5mol/(L•min),同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则氧气反应速率=3.5×10-5mol/(L•min),
故答案为:3.5×10-5mol/(L•min);
③研究催化剂对反应速率的影响,只能让催化剂作为变量,其余的均相同,从数据表格知①和②为研究催化剂对反应速率影响的实验,
故答案为:①和②;除催化剂外,其他条件相同.
点评 本题考查物质制备,涉及化学反应速率和化学平衡有关计算、电解原理、盖斯定律等知识点,侧重考查学生分析计算能力,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:多选题
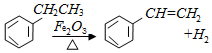 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2、CCl4鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
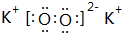 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
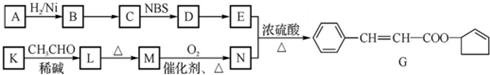
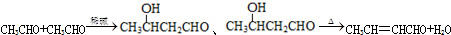
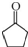 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
.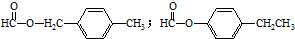 .
.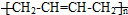 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com