
| A�� | ����������Ӧ���Ȼ������Ƴ�����ⷴӦ�Ƶ⻯�� | |
| B�� | CO2ͨ�뵽Ư����Һ�з���CO2+Ca��ClO��2+H2O=CaCO3��+2HClO���Ƴ�SO2ͨ�뵽Ư����Һ�з���SO2+Ca��ClO��2+H2O=CaSO3��+2HClO | |
| C�� | Na2O2��CO2��Ӧ����Na2CO3��O2���Ƴ�Na2O2��SO2��Ӧ������Na2SO3��O2 | |
| D�� | ���ÿ����Ե�������Һ�백ˮ��Ӧ��Al��OH��3���Ƴ������Ե�������Һ�백ˮ��Ӧ��Fe��OH��3 |
���� A������ⷴӦ���ɵ⻯������
B����������ʹ��������ˮ��Һ�лᷢ��������ԭ��Ӧ��
C������������������������
D�������Ե����κ����ζ��ܺͰ�ˮ���ɳ�����
��� �⣺A�����������������������ӣ���������ⷴӦ���ɵ⻯�������������ɵ⻯������A����
B��SO2ͨ�뵽Ư����Һ�У��������������������������ƣ�����SO2ͨ�뵽Ư����Һ�в�������CaSO3����B����
C����������������������������Na2O2��SO2��Ӧ������Na2SO4����������Na2SO3����C����
D�������Ե����κ����ζ��ܺͰ�ˮ���ɳ������������Ե�������Һ�백ˮ��Ӧ��Al��OH��3�������Ե�������Һ�백ˮ��Ӧ��Fe��OH��3����D��ȷ��
��ѡD��
���� ���⿼�黯ѧ��Ӧ�Ļ���ԭ�����漰���ʵ����ʷ����֪ʶ���Ѷ����У�����ʱҪע��һ���������������Ĺ�ϵ���Լ����������õ������ȣ���


 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
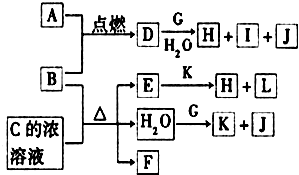 ͼ�У�A��LΪ�������ʻ�����ʵ�ˮ��Һ��B��A������ȼ�ղ����ػ�ɫ�̣�B��GΪ��ѧ��ѧ�г����Ľ������ʣ�E��ϡ��ҺΪ��ɫ��I����ɫ��ӦΪ��ɫ�����J��Ԫ��ԭ�Ӻ���ֻ��һ�����ӣ�FΪ��ɫ���д̼�����ζ�����壬����ʹƷ����Һ��ɫ��
ͼ�У�A��LΪ�������ʻ�����ʵ�ˮ��Һ��B��A������ȼ�ղ����ػ�ɫ�̣�B��GΪ��ѧ��ѧ�г����Ľ������ʣ�E��ϡ��ҺΪ��ɫ��I����ɫ��ӦΪ��ɫ�����J��Ԫ��ԭ�Ӻ���ֻ��һ�����ӣ�FΪ��ɫ���д̼�����ζ�����壬����ʹƷ����Һ��ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�0.5molH2�к��е�Hԭ���� | |
| B�� | 22.4��HCl�����к��е�Clԭ�� | |
| C�� | 1L1mol/L������Һ������H+�� | |
| D�� | 0.1mol���������еĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
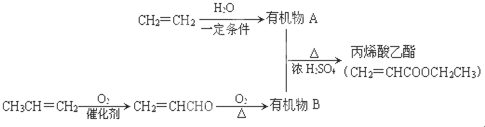
 ����ϩ�����������еĺ���������������̼̼˫����������
����ϩ�����������еĺ���������������̼̼˫����������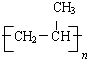 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ
��ͼ Ϊֱ����Դ��
Ϊֱ����Դ�� Ϊ�������Ȼ�����Һ�ͷ�̪��Һ����ֽ��
Ϊ�������Ȼ�����Һ�ͷ�̪��Һ����ֽ��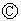 Ϊ��Ʋۣ���ͨ��·����
Ϊ��Ʋۣ���ͨ��·���� �ϵ�c���Ժ�ɫ��Ϊʵ�����϶�п����ͨ
�ϵ�c���Ժ�ɫ��Ϊʵ�����϶�п����ͨ ��ʹc��d�����·������������ȷ���ǣ�������
��ʹc��d�����·������������ȷ���ǣ�������| A�� | aΪֱ����Դ�ĸ��� | B�� | c�������ķ�ӦΪ2H++2e-=H2�� | ||
| C�� | f�缫Ϊп�� | D�� |  ����Һ������ΪFeSO4 ����Һ������ΪFeSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 Lˮ������ԭ������Ϊ3NA | |
| B�� | ���³�ѹ�£�44 gC3H8�к��е�̼̼������Ϊ3NA | |
| C�� | ��״���£�44.8 L NO��22.4L O2��Ϻ������������Ϊ3NA | |
| D�� | 1 molNa2O��Na2O2�����������������������3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��NH3 | B�� | N2��O2 | C�� | CO��CO2 | D�� | H2S��HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 X��Y��Z��W����ѧ��ѧ�������������ʣ�����֮�������ͼ��ʾת����ϵ����������ϲ����ܵ��ǣ�������
X��Y��Z��W����ѧ��ѧ�������������ʣ�����֮�������ͼ��ʾת����ϵ����������ϲ����ܵ��ǣ�������| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al��OH��3 | NaAl��OH��4 | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Mg | MgCl2 | Ti | |
| �۵�/�� | 648.0 | 714 | 1667 |
| �е�/�� | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com