
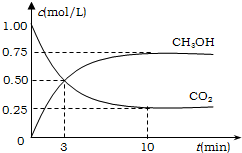
 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.分析 由图象可知 CO2(g)+3H2(g)  CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
以此可计算(1)、(2)、(3)题;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,平衡正向移动,CH3OH(g)、H2O浓度增大,结合平衡常数不变判断.
解答 解:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
(1)v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),故答案为:0.075;
(2)氢气的转化率=$\frac{2.25}{3}$×100%=75%,
故答案为:75%;
(3)衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故C错误;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:AD;
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,平衡正向移动,CH3OH(g)、H2O浓度增大,由于平衡常数不变,则CO2的物质的量浓度也增大,
故答案为:<.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,为高考常见题型,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
 学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:
学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳的捕捉和利用是能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是能源领域的一个重要战略方向.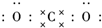 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com