
| A. | 质子数为7、中子数为8的氮原子:87N | |
| B. | 溴化铵的电子式: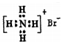 | |
| C. | 乙酸的比例模型: | |
| D. | 间硝基甲苯的结构简式: |
分析 A、质量数A=质子数Z+中子数N;
B、溴化铵的电子式中,铵根离子中氮原子和氢原子的最外层电子数应该标出;
C、比例模型体现分子的结构及原子的相对大小;
D、间硝基甲苯中硝基和甲基为间位的关系.
解答 解:A、质量数A=质子数Z+中子数N,故质子数为7、中子数为7的氮原子的质量数为14,故表示为147N,故A错误;
B、溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: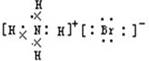 ,故B错误;
,故B错误;
C、比例模型体现分子的结构及原子的相对大小,则乙酸的比例模型为 ,故C错误;
,故C错误;
D、间硝基甲苯中硝基和甲基为间位的关系,故结构简式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见的化学用语的书写,难度不大,应注意的是电子式书写时,阴离子应表示出最外层电子.


科目:高中化学 来源: 题型:填空题
 和
和 等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.
等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | 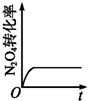 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加足量的KMnO4酸性溶液,然后再加入溴水 | |
| B. | 先加足量溴水,然后再加入KMnO4酸性溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 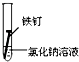 | 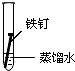 | 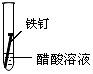 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com