
【题目】在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示,下列叙述错误的是

A. 待镀铁棒为阴极
B. 选用镍棒替换碳棒,镀镍效果更好
C. 通电后中间隔室的NaCl溶液浓度增大
D. 阳极的电极反应式为4OH- — 4e-=O2↑+2H2O
科目:高中化学 来源: 题型:
【题目】下列有关含氯物质的说法不正确的是
A.向新制氯水中加入少量碳酸钙粉末能增强溶液的漂白能力
B.向NaClO溶液中通入少量的CO2的离子方程式:CO2+2ClO-+H2O=2HClO+CO32-(已知酸性:H2CO3>HClO>HCO3-)
C.向Na2CO3溶液中通入足量的Cl2的离子方程式:2Cl2+CO32-+H2O=CO2+2Cl-+2HClO
D.室温下,向NaOH溶液中通入Cl2至溶液呈中性时,相关粒子浓度满足:c(Na+)=2c(ClO-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是

A. 碳酸的电离方程式:H2CO32H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2—2e-=2H+
C. 向FeBr2溶液中通入少量Cl2:2Br-+ Cl2= Br2+2Cl-
D. 如图所示,反应开始时的离子方程式:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的四种实验操作名称从左到右依次是( )
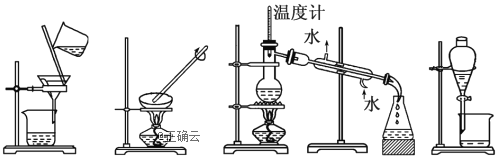
A.过滤、蒸发、蒸馏、分液B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙的实验如下:

Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_______________________________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为______________________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①点燃D处的酒精喷灯; ②打开分液漏斗活塞; ③点燃A处的酒精灯; ④停上点燃A处的酒精灯;⑤停止点燃D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式或离子方程式。
(1)H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨气的离子方程式:____________。
(2)硫化氢具有还原性,可以和许多氧化剂反应。在硫酸溶液中,H2S和KMnO4反应生成S、MnSO4、K2SO4和 H2O,写出该反应的化学方程式:________。
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的离子方程式:__。
(4)FeCl3与KClO在强碱性条件下反应可生成K2FeO4和KCl,写出该反应的离子方程式:____。
(5)催化反硝化法中,H2能将![]() 还原为N2,反应进行一段时间后溶液呈碱性,写出该反应的离子方程式:________。
还原为N2,反应进行一段时间后溶液呈碱性,写出该反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g)2ClNO(g) △H 1<0 其平衡常数为K1
ii.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=__________(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO)=_________ ,平衡常数K2=___________;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:α1(NO2)______α2(NO2)(填“>”“<”或“=”)。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
a.c(Na+)=c(HSO3-)+2c(SO32-)
b.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
c.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
d.c(OH-) +c(SO32-)=c(H2SO3)+c(H+)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则

①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) ![]() 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:


(1)0~20min,A的平均反应速率为_________________;8min时,v(正)___v(逆)(填:>、=或<)
(2)反应方程式中的x=_______,30min时改变的反应条件是________________________。
(3)20~30min时反应的平衡常数_______30~40min时反应的平衡常数(填:>、=或<)。
(4)该反应的正反应为________(填:“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是__________________min。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com