
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A.该离子浓度关系违反了电荷守恒;
B.铵根离子水解促进了水的电离,而硫酸电离出的氢离子抑制了水的电离;
C.反应后溶质为等浓度的醋酸和醋酸钠,根据混合液中的电荷守恒、物料守恒分析;
D.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的电离程度小于其水解程度,则c(H2CO3)>c(CO32-).
解答 解:A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)中阴离子所带负电荷大于阳离子所带正电荷,违反了电荷守恒,故A错误;
B.pH=5的NH4Cl溶液与pH=5的硫酸中,前者铵根离子水解促进了水的电离,而后者硫酸电离出的氢离子抑制了水的电离,两溶液中水的电离程度不同,故B错误;
C.将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,反应后溶质为等浓度的醋酸和醋酸钠,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=2c(Na+),二者结合可得:2c(OH-)+c(CH3COO-)=-c(CH3COOH)+2c(H+),故C正确;
D.pH=9的NaHCO3溶液呈碱性,说明HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

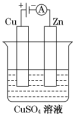
| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用溴水既可以鉴别甲烷和乙烯.也可以除去甲烷中的乙烯 | |
| D. | 可以通过灼烧时的特殊气味来鉴别蛋自质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
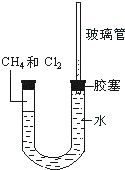 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com