

| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
分析 A.根据结构简式确定元素种类和原子个数,可确定分子式;
B.对乙烯基苯甲酸中羧基和乙烯基可为邻、间、对位置,且苯环的取代基可为乙烯基、醛基和羟基;
C.含有O元素,不属于烃;
D.化合物M含有羧基和I,可发生缩聚反应,乙烯基苯甲酸含有碳碳双键,可发生加聚反应.
解答 解:A.由结构简式可知分子式为C9H8O2,故A错误;
B.对乙烯基苯甲酸中羧基和乙烯基可为邻、间、对位置,且苯环的取代基可为乙烯基、醛基和羟基,则同分异构体大于三种,故B错误;
C.含有O元素,不属于烃,故C错误;
D.化合物M含有羧基和I,可发生缩聚反应,乙烯基苯甲酸含有碳碳双键,可发生加聚反应,且都可发生取代反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,注意把握官能团与性质的关系,熟悉烯烃、酸的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
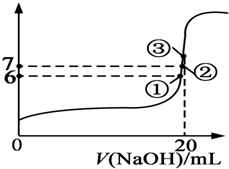 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )| A. | pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 | |
| B. | 在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L | |
| C. | 在②点时,溶液中:c(F-)<c(Na+) | |
| D. | 在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
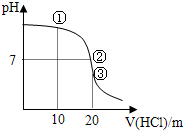
| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒数为5种 | |
| D. | 滴定过程中可能出现:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论使用的石油、煤等传统能源,还是氢能、核能等新能源,归根结底这些能源都是由太阳能转而来 | |
| B. | 铝表面有一层致密的氧化物薄膜具有极强的抗腐蚀能力,故铝制容器可用来贮存酸碱性、腌制性食品等 | |
| C. | 生活中用草木灰制作松花蛋,农业上用福尔马林浸种,工业上用亚硝酸盐处理皮革等,其过程的共同点都是利用了蛋白质变性的性质 | |
| D. | 氯气、次氯酸盐、二氧化氯等含氯化合物都具有强氧化性,能用于杀菌消毒.氯化钾、氯酸钾也是含氯化合物,故也能用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
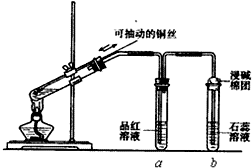 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com