
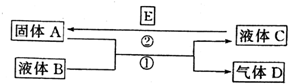
 中学化学中有很多物质可以实现图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.
中学化学中有很多物质可以实现图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.分析 (1)若A是一种紫红色金属,应为铜,气体D能使品红溶液褪色,加热时又恢复原色,应为SO2,A和B的反应为铜和浓硫酸在加热条件下的反应;SO2与另一种气体H混合后生成一种淡黄色固体w,H应为H2S,w为S单质;
(2)若A是一种金属单质,D是密度最小的气体即氢气,如果B是水,说明A是非常活泼的金属,如Na,C为NaOH,不能一步生成Na,所以B不能是水,D是一种无色气体,应为H2,如B为NaOH溶液,则C为NaAlO2,不能发生置换反应生成Al;
(3)D是一种无色气体,遇到空气变为红棕色,应为NO,液体C呈蓝色,说明A为Cu,B为稀硝酸,C为Cu(N03)2.
解答 解:(1)若A是一种紫红色金属,应为铜,气体D能使品红溶液褪色,加热时又恢复原色,应为SO2,A和B的反应为铜和浓硫酸在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2与另一种气体H混合后生成一种淡黄色固体w,H应为H2S,w为S单质,该反应的方程式为2H2S+SO2=3S+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2H2S+SO2=3S+2H2O;
(2)若A是一种金属单质,D是密度最小的气体即氢气,如果B是水,说明A是非常活泼的金属,如Na,C为NaOH,不能一步生成Na,所以B不能是水,D是一种无色气体,应为H2,如B为NaOH溶液,则C为NaAlO2,不能发生置换反应生成Al,
故答案为:B;否;
(3)D是一种无色气体,遇到空气变为红棕色,应为NO,液体C呈蓝色,说明A为Cu,B为稀硝酸,C为Cu(N03)2,反应①的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应②为置换反应,生成Cu,离子方程式可写为Cu2++Fe=Fe2++Cu等,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;Cu2++Fe=Fe2++Cu.
点评 本题考查无机物的推断,题目难度不大,本题注意把握物质的特征性质,为解答推断题的突破口,注意把握相关物质的性质,为解答该题的关键.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
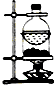 |  | 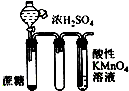 | 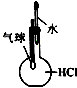 |
| 分离NH4Cl和Ca(OH)2固体 | X为四氯化碳,可用于吸收氨气,并防止倒吸 | 验证浓硫酸的脱水性和强氧化性 | 验证HCl气体在水中的溶解性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷是生物体中不可缺少的元素之一,它能形成多种化合物.
磷是生物体中不可缺少的元素之一,它能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com