
| A. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 以NO和N02为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
分析 A.废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重;
B.光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应;
C.二氧化硫的排放是形成酸雨的主要原因;
D.FeCl3溶液能与Cu反应,离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
解答 解:A.因废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重,所以应积极开发 废电池的综合利用技术,减少土壤和水源的污染,故A正确;
B.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故B正确;
C.二氧化硫的排放是形成酸雨的主要原因,故C错误;
D.FeCl3溶液能与Cu反应,离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故D正确;
故选:C.
点评 本题考查了环境污染与治理、元素化合物的性质,熟悉二氧化硅、氯化铁的性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、Cl-、SO42- | D. | Na、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
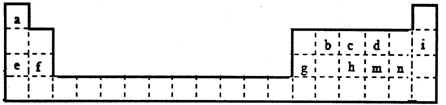
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
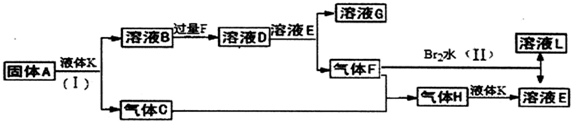
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
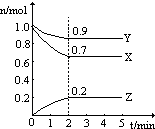
 一定条件下,在某恒容容器中充人N2和H2,反应N2+3H2?2NH3(正反应放热)达到平衡.当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合图中变化的是( )
一定条件下,在某恒容容器中充人N2和H2,反应N2+3H2?2NH3(正反应放热)达到平衡.当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合图中变化的是( )| A. | 充入氮气同时分离出氨 | B. | 升高温度 | ||
| C. | 减小压强 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
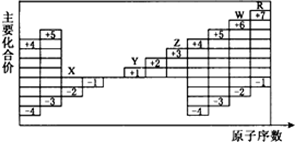
| A. | 五种元素中有三种属于非金属元素,且三种非金属元素均存在同素异形现象 | |
| B. | 五种元素中有两种属于金属元素,且两种金属元素均不能在空气中稳定存在 | |
| C. | 五种元素的单质在固态时分别属于三种不同的晶体类型 | |
| D. | Y、Z、W三种元素的最高价氧化物的水化物相互之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在空气中燃烧 | |
| B. | 乙烯在一定条件下跟HCl反应 | |
| C. | 苯与液溴在FeBr3催化下生成溴苯 | |
| D. | 苯在一定条件下跟H2反应生成环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4g | B. | 0.1mol | C. | 0.05mol | D. | 8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
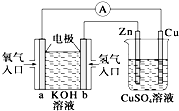
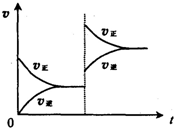
| A. | 左边装置是燃料电池,右边装置是电镀池 | |
| B. | 电子流动方向:b→Zn→CuSO4(aq)→Cu→a | |
| C. | 一段时间后,左端溶液浓度变小,右端溶液浓度不变 | |
| D. | 当锌片的质量变化12.8 g时,a极消耗标准状况下的O2 2.24L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com